THE entalpija formacije, također nazvan standardna entalpija formacije, ili standardna toplina formiranja, je izračun topline koja se oslobađa ili apsorbira pri stvaranju 1 mola tvari iz jednostavnih tvari, u standardnom stanju.
Nemoguće je izračunati apsolutnu vrijednost entalpija svake tvari, ali je moguće izračunati varijaciju entalpije koja se javlja u reakciji pomoću kalorimetra.
Potrebno je to upamtiti dogovoreno je usvajanje vrijednosti entalpije jednake nuli za jednostavne tvari u standardnom stanju. Dakle, ako želimo otkriti koja je entalpija nastanka tvari, trebamo samo znati vrijednost entalpije njezine tvorbene reakcije iz jednostavnih tvari.
Na primjer, želimo pronaći entalpiju od 18 grama vode, što odgovara 1 molu, budući da je njegova molarna masa 18 g / mol. Da bismo to učinili, prvo trebamo reakciju kako bismo stvorili vodu iz jednostavnih tvari, kao što je prikazano dolje:
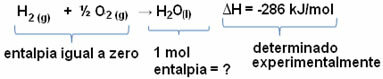
Imajte na umu da je vrijednost promjene entalpije koja se dogodila u ovoj reakciji eksperimentalno određena pomoću kalorimetra i jednaka je -286 kJ / mol.
Formula koja izračunava ovu promjenu entalpije (ΔH) je:
ΔH = HProizvodi - HReagensi
Dakle, budući da već znamo vrijednost ΔH i da je entalpija reaktanata jednaka nuli (budući da su u standardnom stanju jednostavne tvari), onda možemo zaključiti da je entalpijska vrijednost 1 mol vode jednaka entalpijskoj promjeni formacijske reakcije, jer je jedini produkt te reakcije, kao što je prikazano dolje:
ΔH = HProizvodi - HReagensi
-286 kJ / mol = HH2O - (HH2 + H1/2 O2)
-286 kJ / mol = HH2O - 0
HH2O = - 286 kJ / mol
Ova vrsta entalpije, postignuta entalpijom jednostavnih tvari u standardnom stanju, stoga je standardna entalpija formacije (ΔH0).
Sada postoje mnoge tvari koje se ne stvaraju izravno jednom reakcijom, poput vode. U takvim se slučajevima entalpija tvorbe može izračunati iz varijacije entalpije reakcije.
Na primjer, NH4Cl nastaje slijedećom reakcijom:
NH3 + HCl → NH4Kl ΔH = -176 kJ / mol
Imajte na umu da niti jedan od reaktanata nije jednostavna tvar, pa im ne možemo dodijeliti entalpiju nule. Moramo znati entalpije stvaranja svakog od reagensa, jer oni nastaju reakcijama između jednostavnih tvari:
NH3: ΔH = -46 kJ / mol
HCl: ΔH = -92,4 kJ / mol
Zbrajanjem ove dvije entalpije zajedno dobivamo vrijednost entalpije reaktanata i možemo naći entalpiju NH4Cl:
HR = HNH3 + HHCl
HR = (-46 + (-92,4) kJ / mol)
HR = -138,4 kJ / mol
Zamjena u formuli:
ΔH = HProizvodi - HReagensi
-176 = HNH4Cl - ( -138,4)
HNH4Cl = - 176 - 138,4
HNH4Cl = -314,4 kJ / mol
U ovom smo slučaju izravno zbrojili vrijednosti entalpija nastajanja reaktanata, jer je reakcijski omjer bio samo 1 mol. Međutim, ako je u drugim reakcijama količina mola različita, prvo će biti potrebno umnožiti entalpiju stvaranja reaktanta s brojem molova.
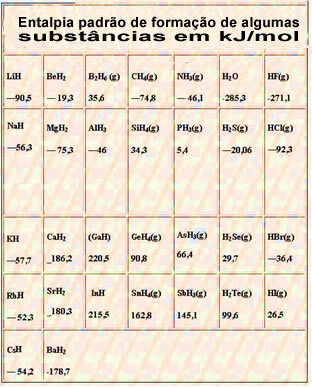
Ispod je tablica sa standardnom entalpijom stvaranja nekih tvari pri 25 ° C i 1 atm:
Napisala Jennifer Fogaça
Diplomirao kemiju
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/entalpia-formacao.htm
