U laboratorijima i kemijskoj industriji vrlo je važno znati količinu tvari koje sudjeluju u reakcijama. Stoga ćemo se u nastavku pozabaviti glavnim pojmovima, veličinama i mjernim jedinicama povezanim s masama atoma:
- Jedinica atomske mase (u):
Standardni referentni atom težine za označavanje jedinice atomske mase je ugljik-12 (12Ç). Jedinica atomske mase (1 u) odgovara vrijednosti 1,66054. 10-24 g, što je masa 1/12 izotopa ugljika s masom jednakom 12 (12Ç).
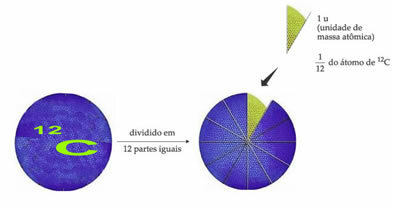
Jedinica atomske mase (u) je jedinica koja se koristi u svim dolje navedenim količinama.
- Atomska masa atoma ili izotopa (MA):
Dobiva se usporedbom s referentnom vrijednošću spomenutom u prethodnoj stavci. Na primjer, atomska masa 919F dobiva spektrometar masa, koji je jednak 18,9984 u. Zaokružujući prema naprijed, jednako je 19, što je ista vrijednost kao i njegov maseni broj (A). Ova vrijednost znači da je atomska masa elementa 919F je 19 puta veća od mase 1/12 12Ç.
- Atomska masa elementa (AM):
Atomska masa elementa određena je ponderiranim prosjekom atomskih masa njegovih izotopa. To se postiže množenjem atomskih masa svakog izotopa s postotkom koji se pojavljuje u strukturi elementa. Te se vrijednosti zatim zbrajaju, koje se dijele sa 100, što rezultira ukupnim postotkom.
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Na primjer, element neon sastoji se od tri izotopa sa slijedećim atomskim masama i postocima u svom sastavu:

Izračunavanje atomske mase (MA) ovog elementa:
LOŠEneon = (20. 90,92) + (21. 0,26) + (22. 8,82)
100
LOŠEneon = 20.179 u
- Molekularna masa (MM):
Kao što naziv govori, koristi se za molekularne tvari, odnosno atome povezane dijeljenjem parova elektrona, koji se nazivaju kovalentnim vezama.
Molekularna masa dobiva se množenjem broja atoma svakog elementa njihovim atomskim masama i zbrajanjem rezultata.
Na primjer, molekula CO2 sadrži jedan ugljik i dva kisika, pa ćemo umnožiti atomsku masu ugljika s 1; i kisik za dva, dodajući ih kasnije:
MMCO2 = (1. LOŠEÇ) + (2. LOŠEO)
MMCO2 = (1. 12) + (2. 16)
MMCO2 = 12 + 32
MMCO2 = 44 u
- Masovna formula:
Isti je izračun izveden za molekularnu masu, međutim, za ionske spojeve. U ovom je slučaju naziv drugačiji, jer nisu grupirani u molekule, već u nakupine iona. Kako molekule ne postoje, očito nema smisla govoriti o molekularnoj masi, ali obrazloženje izračuna je isto.
Primjer:
NaCl
↓ ↓
23 +35,5 → Masa formule = 58,5 u
Napisala Jennifer Fogaça
Diplomirao kemiju
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
FOGAÇA, Jennifer Rocha Vargas. "Mase atoma"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/massas-dos-atomos.htm. Pristupljeno 28. lipnja 2021.