Općenito, čiste tvari rijetko se mogu naći izolirano u prirodi, jer se mogu naći u obliku smjese, odnosno povezan s drugim tvarima. To znači da smo mi i gotovo sve oko nas primjeri smjesa najrazličitijih čistih tvari.
U ovom ćemo tekstu naučiti što je to i kakve su klasifikacije čistih tvari i smjesa.
čiste tvari
čiste tvari su materijali koji imaju kemijski sastav i Svojstva stalne fizikalne i kemijske, jer se ne mijenjaju pri stalnom tlaku i temperaturi.
Općenito govoreći, čiste tvari mogu se klasificirati na dva načina:
a) Jednostavne tvari
Oni su kemijski spojevi nastali atomima istog kemijskog elementa. Na primjer:
→ H2 (Vodikov plin)
Molekule plinovitog vodika tvore dva atoma kemijskog elementa Vodik, pa je to jednostavna tvar.
→ O3 (Ozonski plin)
Molekule ozonskog plina tvore tri atoma kemijskog elementa Kisik, pa je to jednostavna tvar.
Također postoji mogućnost da atomi istog kemijskog elementa tvore potpuno različite jednostavne tvari, alotrope. Primjer za alotropija ovo je slučaj kemijskog elementa kisika koji tvori plinovite tvari kisik (O2) i ozonski plin (O3).
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
B) složene tvari
Oni su kemijski spojevi nastali atomima različitih kemijskih elemenata. Primjeri:
→ CO2 (Ugljični plin ili ugljični dioksid)
Molekule ugljičnog dioksida tvore jedan atom elementa ugljik i dva atoma elementa kisik. Kako su kemijski elementi različiti, riječ je o složenoj tvari.
→ kmnO4 (Kalijev permanganat)
O ion-formula kalijevog permanganata tvori jedan atom elementa kalij, jedan atom elementa mangan i četiri atoma elementa kisik.
Mapa uma: čista tvar i smjesa

* Za preuzimanje mape uma u PDF-u, Kliknite ovdje!
Smjese
Miješati to je spoj dviju ili više različitih tvari (bez obzira jesu li jednostavne ili složene). Ima fizikalne karakteristike (talište, vrelište, gustoća, žilavost itd.) Koje su različite i varijabilne (nisu fiksne) u odnosu na tvari koje ga čine.
Smjesa vode i natrijevog klorida, na primjer, ima potpuno različito talište u odnosu na talište vode (0OC) i natrijev klorid (803OC) sam.
a) Homogene smjese
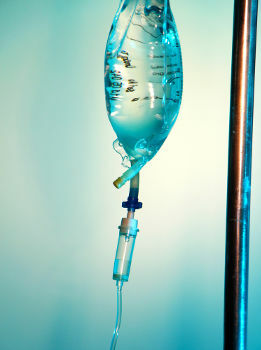
Fiziološka otopina je homogena smjesa koju tvore voda, glukoza i natrijev klorid
Homogene smjese imaju samo jednu fazu (jedan vizualni izgled). Nastaju kada jedan materijal ima sposobnost otapanja drugog. Primjeri:
voda i natrijev klorid;
voda i glukoza;
benzin i etanol;
atmosferski zrak (plin kisik, plin dušik, ugljični dioksid, vodena para itd.);
octena kiselina i voda;
nafta (benzin, petrolej, ulje za podmazivanje itd.);
fiziološka otopina.
b) Heterogene smjese

Mlijeko je heterogena smjesa jer ima tekuću fazu (voda) i krutu fazu (masnoća)
Heterogene smjese imaju više od jedne faze (dva ili više vizualnih aspekata). Nastaju kada jedan materijal ne otopi drugi. Primjeri:
Granit;
Mlijeko;
Krv;
Voda i pijesak;
Voda ovo je Leo;
Voda i benzin.
* Mind Map Victora Ricarda Ferreire
Učitelj kemije
Ja, Diogo Lopes Dias
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
DANI, Diogo Lopes. "Čiste tvari i smjese"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/mistura-e-substancias-puras.htm. Pristupljeno 28. lipnja 2021.
Kemija

Pogledajte definiciju osnovnih kemijskih pojmova kao što su tvar, energija, tvar, smjesa, tijelo, objekt, masa, volumen i sustav.



