Čistu tvar tvori jedna vrsta kemijskih vrsta, tj. Njezin sastav i svojstva su utvrđeni. Mješavina sadrži više od jedne vrste komponenata, pa se njezina organizacija razlikuje.
Dakle, čistu tvar možemo razlikovati od smjese samo kad znamo njezin sastav.
Kada uspoređujemo čašu vode i čašu otopljenog šećera, naše oči ne primjećuju nikakvu razliku. Međutim, ako unesemo sadržaj dviju čaša, primijetit ćemo da je jedna čista tvar, a druga se sastoji od smjese.
čiste tvari
Čista tvar je skup samo jedne kemijske vrste, odnosno nije pomiješana s drugima.
Uzmimo za primjer vodu. Voda (H2O) prepoznat je po svojim karakteristikama, a specifična svojstva ovog materijala pomažu nam da ga identificiramo. Glavni svojstva vode oni su:
| Gustoća | 1,00 g / cm3 |
|---|---|
| Tačka fuzije | 0 ° C |
| Vrelište | 100 ° C |
Kad materijal u cijelosti ima fiksna i nepromjenjiva svojstva, kažemo da je čista tvar.
Kad u čašu vode stavimo kuhinjsku sol, natrijev klorid (NaCl) i promiješamo, dogodit će se promjena.

Rezultat je proizvod srednje gustine između gustoće vode i soli. To je zato što voda više nije čista tvar i postala je Miješati.
Pokušavajući zamrznuti ovu smjesu, primijetit ćete da će temperatura topljenja biti manja od 0 ° C i to također ova smjesa neće kipjeti na 100 ° C, trebat će više topline da to ispari proizvod.
Čiste jednostavne i složene tvari
Čiste tvari klasificiraju se kao jednostavne kada u njihovom sastavu postoje atomi samo jednog kemijskog elementa.
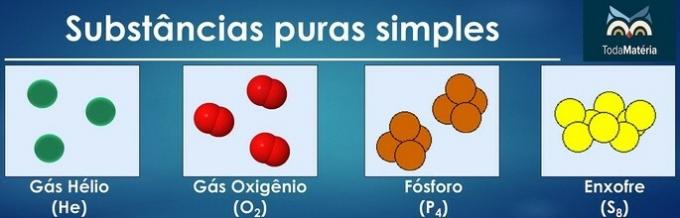
Raspored atoma dvaju ili više kemijskih elemenata tvore čiste kompozitne tvari.

Smjese
Smjesa odgovara spajanju dviju ili više čistih tvari, koje se nazivaju komponentama.
Za razliku od čistih tvari, njegova svojstva nisu fiksna jer ovise o udjelu komponenata u smjesi.
Pogledajte kako gustoća, fizičko svojstvo, varira s količinom soli pomiješane s vodom.
| Postotak soli u ukupna masa smjese |
Gustoća smjese (g / cm3) na 20 ° C |
|---|---|
| 1 | 1,005 |
| 8 | 1,056 |
| 12 | 1,086 |
| 16 | 1,116 |
| 26 | 1,197 |
Izvor: FURNISS, B. S. i sur. Vogelov udžbenik iz praktične organske kemije. 4. izd. London: Longman, 1987 (monografija). P. 1.312.
Prema tome, dodavanje vode i soli, u bilo kojem omjeru, ima promjenljivu gustoću, pa stoga ne možemo smjesu klasificirati ni kao vodu ni kao sol.
Homogene i heterogene smjese
Homogene smjese su one koje sastojke predstavljaju u samo jednoj fazi i, prema tome, jednaka svojstva u svim točkama.

Kada vizualno opažamo više od jedne faze, tada je smjesa klasificirana kao heterogena.

Sažetak o čistim tvarima i smjesama
| Čiste tvari i smjese | |
|---|---|
|
homogeni sustav (samo jedna faza) |
čista tvar (jedna komponenta) |
|
homogena smjesa (više od jedne komponente u istoj fazi) | |
|
heterogeni sustav (više od jedne faze) |
čista tvar (komponenta u različitim agregatnim stanjima) |
|
heterogena smjesa (više od jedne komponente u više od jedne faze) |
Da biste saznali više, provjerite ove tekstove:
- Atomi
- Kemijski elementi
- Odvajanje smjesa
Vježbe s komentiranim povratnim informacijama
1. (UFMG) Uzorku čiste tvari X utvrđena su neka od svojstava. Sve alternative imaju svojstva koja su korisna za prepoznavanje ove tvari, osim:
a) gustoća.
b) masa uzorka.
c) topljivost u vodi.
d) temperatura ključanja.
e) temperatura topljenja.
Pogrešna alternativa: b) masa uzorka.
a) TOČNO. Gustoća je količina materije u danom volumenu. Kao svojstvo specifično za materijal, korisno je za identificiranje tvari.
b) POGREŠNO. Masa je količina materije u tijelu. Budući da se ovo svojstvo odnosi na bilo koju materiju, bez obzira na njezinu građu, nije je moguće koristiti za identifikaciju tvari.
c) TOČNO. Topljivost je sposobnost tvari da se otopi ili ne u određenoj tekućini. Kao svojstvo specifično za materijal, korisno je za identificiranje tvari.
d) TOČNO. Temperatura vrenja odgovara temperaturi promjene iz tekućeg u plinovito stanje. Kao svojstvo specifično za materijal, korisno je za identificiranje tvari.
e) TOČNO. Temperatura topljenja odgovara temperaturi promjene iz tekućeg u kruto stanje. Kao svojstvo specifično za materijal, korisno je za identificiranje tvari.
2. (Vunesp) Oznaka boce mineralne vode prikazana je u nastavku.
| Vjerojatni kemijski sastav: |
|---|
| Kalcijev sulfat 0,0038 mg / L |
| Kalcijev bikarbonat 0,0167 mg / L |
Na temelju ovih podataka mineralnu vodu možemo klasificirati kao:
a) čista tvar.
b) jednostavna tvar.
c) heterogena smjesa.
d) homogena smjesa.
e) koloidna suspenzija.
Ispravna alternativa: d) homogena smjesa.
a) POGREŠNO. Voda bi bila čista da njen sastav sadrži samo molekule H2O.
b) POGREŠNO. Jednostavna tvar sastoji se od atoma samo jednog kemijskog elementa. Čista voda također nije jednostavna tvar jer je tvore atomi vodika i kisika (H2O) klasificiran je kao kompozitni.
c) POGREŠNO. Heterogena smjesa ima više od jedne faze, u tom slučaju možemo promatrati samo vodu.
d) TOČNO. Kako ima samo jednu fazu, sustav je homogen. Kada gledamo bocu s vodom, možemo vidjeti samo tekućinu, jer su spojevi kalcijevog sulfata i kalcijevog bikarbonata topljivi u vodi i zato su otopljeni.
e) POGREŠNO. Koloidna suspenzija je heterogena smjesa čije se komponente razlikuju pomoću mikroskopa.
3. (UCDB) U kemijskom laboratoriju pripremljene su sljedeće smjese:
Ja voda / benzin
II. voda / sol
III. voda / pijesak
IV. benzin / sol
V. benzin / pijesak
Koje su od ovih smjesa homogene?
a) Nijedna.
b) Samo II.
c) II i III.
d) I i II.
e) II i IV.
Točna alternativa: b) Samo II.
a) POGREŠNO. Voda je anorganski spoj, a benzin organski spoj. Te tvari nemaju sposobnost interakcije, a budući da imaju različitu gustoću, tvore heterogenu smjesu.
b) TOČNO. Sol, natrijev klorid, otapa se u vodi stvarajući otopinu, koja je homogena smjesa.
c) POGREŠNO. Pijesak, silicijev dioksid, tvori heterogenu smjesu s vodom.
d) POGREŠNO. Sol je anorganski spoj, a benzin organski spoj. Te tvari nemaju sposobnost interakcije, a budući da imaju različitu gustoću, tvore heterogenu smjesu.
e) POGREŠNO. Pijesak je anorganski spoj, a benzin organski spoj. Te tvari nemaju sposobnost interakcije i stoga tvore heterogenu smjesu.
4. (Ufes) U dobro izmiješanom sustavu koji se sastoji od pijeska, soli, šećera, vode i benzina, broj faza je:
a) 2.
b) 3.
c) 4.
d) 5.
e) 6.
Ispravna alternativa: b) 3.
FAZA 1: Sol i šećer sposobni su za interakciju s vodom, a molekule se pomoću intermolekularnih sila vežu i tvore otopinu koja je homogena smjesa.
FAZA 2: Voda je anorganski spoj, a benzin organski spoj. Te tvari nemaju sposobnost interakcije, a budući da imaju različitu gustoću, tvore heterogenu smjesu.
FAZA 3: Pijesak je silikat koji nema kemijski afinitet s vodom i benzinom i, prema tome, predstavlja fazu.
5. (Mackenzie) Smjesa koju tvore:
a) kocke leda i vodena otopina šećera (glukoza).
b) N plinova2 i CO2.
c) voda i aceton.
d) voda i sirup od ogrozda.
e) kerozin i dizel ulje.
Ispravna alternativa: a) kocke leda i vodena otopina šećera (glukoza).
a) TOČNO. Moguće je promatrati dvije faze: kockice leda i otopinu glukoze, pa su heterogeni sustav.
b) POGREŠNO. Plinovi su uvijek homogena smjesa.
c) POGREŠNO. Vodikove veze nastaju između karbonila propanona i molekule vode. Kako su polarne tvari, aceton se može otapati u vodi i stvoriti homogenu smjesu.
d) POGREŠNO. Ove se dvije komponente miješaju kako bi stvorile homogeni sustav, jer ćemo iz sirupa od ogrozda vidjeti samo crvenu tekućinu, jer se dodavanjem vode događa razrjeđenje.
e) POGREŠNO. Oboje su organski spojevi i zbog kemijskog afiniteta čine jednu fazu, koja predstavlja homogeni sustav.
Provjerite svoje znanje vježbama:
- Vježbe na homogenim i heterogenim smjesama
- Vježbe za odvajanje smjesa
- Vježbe na svojstvima materije


