U tekstu "Koncentracija u mol / L ili molaritet”Vidjeli ste da se koncentracija u mol / L odnosi na količinu tvari u otopljenoj supstanci (n1, mjereno u molima) s volumenom otopine u litrama (V). Međutim, postoje neke otopljene tvari koje, kad se stave u vodu, stvaraju ione.
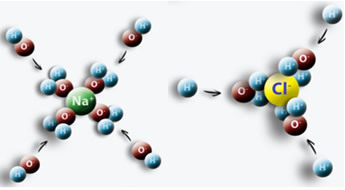
Primjer je kada u vodu stavimo sol (NaCl), javlja se privlačnost između pozitivnog pola vode s Cl i negativnog pola s Na, što dovodi do pojave iona Na+ i Cl-.
Važno je znati odrediti koncentraciju ovih iona u molima / L, jer to može biti korisno u mnogim situacijama. Jedno od područja koje to koristi je lijek, posebno u medicinskim pretragama krvi. Naša krv i druge tjelesne tekućine imaju otopljene ione. Ako je koncentracija ovih iona u našoj krvi iznad ili ispod normalne, to može ugroziti pravilan rad našeg tijela i dovesti do poremećaja i bolesti.
Vidi slučaj željeznih iona (Fe2+): ako osobi nedostaje ovaj ion, može razviti anemiju. Dakle, kad se nekome tko ima anemiju kaže da mora jesti hranu bogatu željezom ili čak neki lijek koji sadrži željezo, to je zapravo ion željeza, a ne metalni element.
Drugi je slučaj kada dolazi do gubitka iona kalcija (Ca2+) u kostima, uzrokujući osteoporozu, kao što je prikazano na fotografijama s uvećanim slikama kostiju ispod:

Pogledajte druge primjere iona koji imaju vitalne funkcije u našem tijelu i trebaju biti u ispravnoj koncentraciji:

Stoga, s obzirom na ove podatke, postaje očito da je znati izračunati koncentraciju iona u otopinama doista važno. Ali kako se to može učiniti?
Koncentracije iona u otopinama u mol / L moguće je odrediti ako su poznata dva bitna podatka, a to su:
- Formule tvari otopljenih u vodi;
- Molarnost vaših rješenja.
S tim podacima napiši jednadžbu disocijacije ili ionizacije dotične otopljene tvari i odbitkom pronađi koncentraciju iona, kao proporcionalan je broju molova svakog iona. To znači da je koncentracija iona proporcionalna njihovim koeficijentima u jednadžbi ionizacije ili disocijacije.
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Pogledajte sljedeći primjer da biste bolje razumjeli kako se vrši ovaj izračun:
"Uzmite u obzir da koncentracija u količini tvari date vodene otopine magnezijevog fosfata (Mg3(PRAH4)2 je 0,5 mol / L. Kolika će biti koncentracija kationa magnezija u mol / L (Mg2+(ovdje)) i fosfatni anioni (PO3-4 (vod.)) u ovom rješenju, s obzirom na to da je stupanj disocijacije (α) bio 100%? "
Prvi korak u rješavanju ovog problema je pisanje jednadžbe disocijacije ili ionizacije. Ako imate poteškoća, možete se temeljiti na donjoj generičkoj jednadžbi:
1 AxBg → x A+ god + y B-x
1 mol x mol y mol
Dakle, s obzirom na ovaj primjer da se magnezijev fosfat potpuno disocirao, imamo sljedeću jednadžbu:
1 mg3(PRAH4)2 (vod.) → 3 mg2+(ovdje) + 2 gp3-4 (vod.)
1 mol 3 mol 2 mol
Možemo vidjeti da 1 mol Mg3(PRAH4)2 daje 3 mol Mg2+(ovdje) i 2 mola PO3-4 (vod.); tako će broj molova kationa biti 3 puta veći od broja molova fosfata s kojim je pripremljena otopina, a aniona 2 puta.
Kako je otopina 0,5 mol / L Mg3(PRAH4)2 (vod.) , to znači da je u 1 L otopljeno 0,5 mol Mg3(PRAH4)2, što je dalo 1,5 mol / L Mg2+(ovdje) i 1,0 mol / L PO3-4 (vod.):
1 mg3(PRAH4)2 (vod.) → 3 mg2+(ovdje) + 2 gp3-4 (vod.)
1 mol 3 mol 2 mol
0,5 mol x god
1. 0,5 3. 0,5 2. 0,5
0,5 mol / L 1,5 mol / L1,0 mol / L
Ali što ako stupanj disocijacije ili ionizacije nije bio 100%? Recimo da je bilo 70%, kako bismo saznali koncentraciju ovih iona u mol / L?
U tom slučaju, samo izvedite jednostavno pravilo od tri. Pogledaj ispod:
1,5 mol / L Mg2+(ovdje) 100 %
x 70%
x = 70. 1,5 → x = 1,05 mol / L iona Mg2+(ovdje)
100
1,5 mol / L PO3-4 (vod.) 100 %
y 70%
y = 70. 1,0 → y = 0,70 mol / L PO iona3-4 (vod.)
100
Napisala Jennifer Fogaça
Diplomirao kemiju
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
FOGAÇA, Jennifer Rocha Vargas. "Koncentracija jona u mol / L"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/concentracao-dos-ions-mol-l.htm. Pristupljeno 28. lipnja 2021.
Kemija

Disocijacija i jonizacija, talijanski znanstvenik Volta, električna struja, švedski fizikalni kemičar Svant August Arrhenius, teorija Arrhenius, pozitivni ioni, kationi, negativni ioni, anioni, kaustična soda, kuhinjska sol, polarne molekule, disocijacija ionski,