Vas aldehidi i ketoni vrlo su slične organske funkcije. Oboje u svojoj strukturi imaju karbonilnu funkcionalnu skupinu (C = O), s jedinom razlikom koja, u slučaju aldehida, uvijek se pojavljuje na kraju ugljikovog lanca, tj. jedan od karbonilnih ugljikovih liganada je vodik; ketoni imaju karbonil između dva druga atoma ugljika.
Aldehidi funkcionalna skupina:Funkcionalna skupina ketona:
O O
║ ║
C C ─ H C C ─ C
Iz tog razloga postoje slučajevi funkcionalne izomerije između aldehida i ketona. Na primjer, u nastavku donosimo dva funkcionalna izomera koji imaju istu molekulsku formulu (C3H6O), ali jedan je aldehid (propanal), a drugi je keton (propanon). Pogledajte kako ovo u potpunosti mijenja njihova svojstva i primjene:
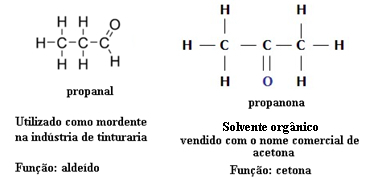
Primjer izomerije funkcije između aldehida i ketona
Zamislite da ste u laboratoriju i nađete bočicu s bezbojnom tekućinom koja ima samo molekularnu formulu C3H6O. Što biste učinili da biste saznali radi li se o ketonu ili aldehidu?
Da biste riješili ovakve probleme, postoje metode za razlikovanje aldehida i ketona temeljene na reakciji ovih spojeva protiv slabih oksidirajućih sredstava. Kako je prikazano dolje, kada se suoče sa slabim oksidansima, aldehidi reagiraju oksidiranjem, dok ketoni ne reagiraju. Mi to kažemoaldehidi djeluju kao redukcijski agensi, ali ketoni ne, reagiraju samo kao redukcijska sredstva u dodiru s energetskim oksidansima.
Aldehidi + slabi oksidanti → karboksilna kiselina
O O
║ ║
C ─ C ─ H + [O] → C ─ C ─ OH
Ketoni + slabi oksidanti → Ne reagirati
O
║
C ─ C ─ C + [O] → Ne dolazi do reakcije
Na temelju toga dovoljno je provesti ovu reakciju i vidjeti reagira li spoj ili ne. Ako reagira, znamo da je aldehid; ako ne reagira, to je keton.
Uz to, proizvodi koji nastaju u tim reakcijama oksidacije aldehida prilično su vidljivi, a dolazi do promjena boje, kao što će se pokazati kasnije.
Tri su glavne metode razlikovanja aldehida i ketona, a to su:
1- Tollens reaktivni: Ovaj reagens je amonijačna otopina srebrovog nitrata, tj. sadrži srebrni nitrat (AgNO3) i višak amonijevog hidroksida (NH4OH):
AgNO3 + 3 NH4OH → Ag (NH3)OH + NH4NA3 + 2 H2O
Tollens Reactive (nazvan po njemačkom kemičaru Bernhardu Tollensu (1841-1918))
Kao što je objašnjeno u tekstu Izrada srebrnog ogledala, kada se aldehid dovede u kontakt s Tollensovim reaktivnim sastojkom, oksidira se u odgovarajuću karboksilnu kiselinu, dok se ioni srebra reduciraju na Ag0 (metalik srebro). Ako se ova reakcija izvede, na primjer, u epruveti, ovo metalno srebro će se taložiti na stijenkama cijevi, što će rezultirati stvaranjem filma koji se naziva srebrno ogledalo. Ovaj zapaženi rezultat vrlo je lijep i koristi se u procesu proizvodnje industrijskih zrcala.
Reakcija koja se odvija može se predstaviti na sljedeći način:
O O
║ ║
R ─ C ─ H + H2O → R ─ C ─ OH + 2e- + 2 H+
2 Ag+ + 2e- → 2 Ag0
2 NH3 + 2 H+ → 2 NH4+
O O
║║
R C ─ H + 2 Ag+ + 2 NH3 + H2O → R C ─ OH + 2 Ag0 + 2 NH4+
aldehid Tollens reaktivankarboksilna kiselina metalik srebro (srebrno ogledalo)
S druge strane, ako keton stavimo u reakciju s Tollensovim reagensom, neće doći do stvaranja metalnog srebra, jer ketoni ne mogu reducirati ione Ag.+.
2- Fehlingova reaktivna reakcija: Ova reaktivna reakcija je plava otopina bakrenog sulfata II (CuSO4) u baznom mediju, jer se miješa s drugom otopinom koju tvore natrijev hidroksid (NaOH) i natrijev i kalijev tartrat (NaOOC-CHOH-CHOH-COOK). Tartrat se dodaje otopini bakar II sulfata kako bi se stabilizirao i spriječio njegovo taloženje.
CUSO4 + 2 NaOH → Na2SAMO4 + Cu (OH)2
Fehling Reactive (nazvan po njemačkom kemičaru Hermannu von Fehlingu (1812. - 1885.))
U dodiru s Fehlingovom reaktivnom smjesom, aldehid tvori karboksilnu kiselinu njezinom oksidacijom, dok ioni bakra (Cu)2+) prisutni u sredini reducirani su, formirajući crvenkasto-smeđi talog (sličniji cigli), koji je bakreni oksid. Ketoni, s druge strane, ne reagiraju - jer ne mogu smanjiti Cu ione2+.
O O
║ ║
R ─ C ─ H + 2 Cu (OH)2 → R ─ C ─ OH + Dupe2O + 2 H2O
aldehid crvenkastosmeđi talog
3- Benediktova reaktiva: Ovaj reaktivni sastojak također nastaje otopinom bakar II sulfata (Cu (OH)2) u osnovnom mediju, ali je pomiješan s natrijevim citratom.
Kao i kod Fehlingova reagensa, u slučaju reakcije između aldehida i Benediktovog reagensa postoje i ioni bakra (Cu2+) prisutni u mediju koji su reducirani i tvore crveni bakreni oksid.
Ovaj se reagens široko koristi u testovima za otkrivanje prisutnosti i sadržaja glukoze u mokraći. Glukoza u svojoj strukturi ima aldehidnu skupinu, pa reagira s Benedictovim reagensom koji je prisutan u trakama za ove testove. Odatle samo usporedite boju vrpce s bojom ljestvice na pakiranju proizvoda.

Benediktov reagens koristi se za određivanje sadržaja glukoze u mokraći.
Napisala Jennifer Fogaça
Diplomirao kemiju
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/diferenciacao-aldeidos-cetonas.htm
