हलोजन अभिक्रियाएँ एक प्रकार की कार्बनिक प्रतिस्थापन अभिक्रियाएँ हैं, अर्थात् वे जिनमें a परमाणु या परमाणुओं के समूहों को परमाणुओं या किसी अन्य अणु के परमाणुओं के समूहों द्वारा प्रतिस्थापित किया जाता है जैविक।
आम तौर पर, इस प्रकार की प्रतिक्रिया अल्केन्स और एरोमैटिक हाइड्रोकार्बन (बेंजीन और इसके डेरिवेटिव) के साथ होती है।
हैलोजनीकरण इसलिए कहा जाता है क्योंकि यह हैलोजन के सरल पदार्थों के साथ होता है: F2, क्लू2, भाई2 अरे2. हालांकि, इनमें से सबसे आम हैं क्लोरीनीकरण (Cl .)2) और ब्रोमिनेशन (Br2), क्योंकि फ्लोरीन बहुत प्रतिक्रियाशील है, और इसकी प्रतिक्रियाएं विस्फोटक और नियंत्रित करने में मुश्किल होती हैं, यहां तक कि कार्बनिक पदार्थों को भी नष्ट कर देती हैं:
चौधरी4(जी) + 2 एफ2(जी) → सी(ओं) + 4एचएफ(छ)
आयोडीन के साथ अभिक्रियाएँ अत्यंत धीमी होती हैं।
हैलोजन के मुख्य प्रकार और कुछ उदाहरण नीचे दिए गए हैं:
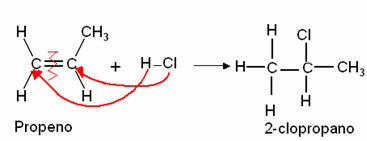
1. अल्केन्स के साथ हलोजन: चूंकि अल्केन्स खराब प्रतिक्रियाशील होते हैं, इसलिए उनकी हैलोजन प्रतिक्रियाएं केवल सूर्य के प्रकाश (λ), पराबैंगनी प्रकाश या मजबूत हीटिंग की उपस्थिति में होती हैं। इस प्रकार की अभिक्रिया ऐल्किल हैलाइड प्राप्त करने के लिए की जाती है।
उदाहरण: मीथेन मोनोक्लोरिनेशन:

इस मामले में यह मीथेन के हाइड्रोजन परमाणु से हुआ (CH .)4) मोनोक्लोरोमीथेन देकर क्लोरीन परमाणु द्वारा प्रतिस्थापित किया जाता है। यदि बहुत अधिक क्लोरीन होता, तो मीथेन में सभी हाइड्रोजेन की जगह, यह प्रतिक्रिया जारी रह सकती है।
१.१. 3 से अधिक कार्बन वाले अल्केन्स में हलोजनीकरण: यदि अभिक्रिया की जाने वाली एल्केन में कम से कम 3 कार्बन परमाणु हों, तो हम विभिन्न प्रतिस्थापित यौगिकों के मिश्रण के साथ समाप्त होते हैं। मिथाइलब्यूटेन मोनोक्लोरिनेशन का उदाहरण नीचे देखें:
अब मत रोको... विज्ञापन के बाद और भी बहुत कुछ है;)

प्रत्येक यौगिक की मात्रा आसानी के निम्नलिखित क्रम के समानुपाती होगी जिसके साथ हाइड्रोजन अणु में छोड़ा जाता है:

इस प्रकार, उपरोक्त मामले में, सबसे बड़ी राशि 2-मिथाइल-2-क्लोरोब्यूटेन होगी और सबसे छोटी राशि 2-मिथाइल-1-क्लोरोब्यूटेन होगी।
2. बेंजीन हलोजन: बेंजीन सामान्य रूप से क्लोरीन या ब्रोमीन के साथ प्रतिक्रिया नहीं करता है। हालांकि, अगर एक लुईस एसिड उत्प्रेरक के रूप में प्रयोग किया जाता है (आमतौर पर FeCl का उपयोग किया जाता है3, फरवरी3 या AlCl3, सभी निर्जल रूप में), बेंजीन एक हलोजन प्रतिक्रिया में आसानी से प्रतिक्रिया करता है।
क्लोराइड और फेरिक ब्रोमाइड केवल मिश्रण में लोहे को मिलाकर प्राप्त किया जा सकता है और इस तरह यह हैलोजन के साथ प्रतिक्रिया करता है और लुईस एसिड का उत्पादन करता है:
2 Fe + 3 Br2 → 2 फरवरी3
बेंजीन हैलोजन और उसके तंत्र का एक उदाहरण देखें:

3. बेंजीन डेरिवेटिव का हलोजन:ऐसे मामलों में, प्रतिस्थापन प्रतिस्थापन या कार्यात्मक समूह द्वारा निर्देशित होता है जो सुगंधित नाभिक से जुड़ा होता है। यह कैसे होता है, यह देखने के लिए पाठ पढ़ें "बेंजीन रिंग में स्टीयरिंग रेडिकल" तथा "मेटा और ऑर्थो-टू-डायरेक्टर्स रेडिकल्स के इलेक्ट्रॉनिक प्रभाव”.
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
क्या आप इस पाठ को किसी स्कूल या शैक्षणिक कार्य में संदर्भित करना चाहेंगे? देखो:
FOGAÇA, जेनिफर रोचा वर्गास। "कार्बनिक हलोजन प्रतिक्रियाएं"; ब्राजील स्कूल. में उपलब्ध: https://brasilescola.uol.com.br/quimica/reacoes-organicas-halogenacao.htm. 28 जून, 2021 को एक्सेस किया गया।