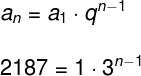तापमान और दबाव की समान स्थितियों को देखते हुए, गैस द्वारा कब्जा कर लिया गया आयतन उसके अणुओं की मात्रा (मोलों की संख्या) के सीधे आनुपातिक होता है।
ऊपर दिए गए उदाहरण में ध्यान दें, दोनों कंटेनर एक ही गैस के साथ हैं और समान तापमान और दबाव की स्थिति के अधीन हैं। यदि हम के मोलों की संख्या घटा दें 2 नहीं के लिये नहीं न, मात्रा भी घट जाती है: यह से जाता है 2 वी के लिये वी.
इससे हम यह निष्कर्ष निकालते हैं कि आयतन और मोलों की संख्या के बीच संबंध स्थिर है:
वी = के
नहीं न
गैसों का मोलर आयतन: किसी दिए गए दबाव और तापमान पर किसी भी गैस के एक मोल द्वारा कब्जा कर लिया गया आयतन।
मोलर आयतन = २२.४ एल/मोल
यह मान तापमान और दबाव की सामान्य स्थिति (सीएनटीपी) - 1 एटीएम और 273 के तहत किए गए प्रयोगों का परिणाम है।
दाढ़ की मात्रा अवोगैड्रो की परिकल्पना (1811 में एमेडियो अवोगैड्रो द्वारा बनाई गई) का अनुसरण करती है, जहां समान तापमान और दबाव पर विभिन्न गैसों के समान मात्रा में मोल की संख्या समान होती है।
लिरिया अल्वेस द्वारा
रसायन विज्ञान में स्नातक
ब्राजील स्कूल टीम
और देखें!
गैस और एरोसोल कानून
सामान्य रसायन शास्त्र - रसायन विज्ञान - ब्राजील स्कूल
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/quimica/volume-molar-gases.htm