कोणीय ज्यामिति कई प्रकारों में से एक है आणविक ज्यामिति, जो अभी भी रैखिक, पिरामिडनुमा, समतल त्रिकोणीय हो सकता है, चतुष्फलकीय, आदि। कोणीय ज्यामिति केवल उन अणुओं में पाई जा सकती है जिनमें निम्नलिखित विशेषताएं हैं:
त्रिपरमाण्विक अर्थात् उनके केवल तीन परमाणु होते हैं;
केंद्रीय परमाणु में कम से कम तीन इलेक्ट्रॉन बादल हों।
ध्यान दें: इलेक्ट्रॉनिक बादल सब है सहसंयोजक बंधन (सिंगल, डबल, ट्रिपल या कोऑर्डिनेट) परमाणुओं और इलेक्ट्रॉन जोड़े के बीच between संयोजकता परत जो कॉल में भाग नहीं ले रहे हैं।
कोणीय ज्यामिति वाले अणुओं के कुछ उदाहरण देखें:
पहला उदाहरण: पानी (एच2ओ)

पारंपरिक जल संरचना
जल संरचना में, हमारे पास है:
तीन परमाणु: दो हाइड्रोजन और एक ऑक्सीजन;
ऑक्सीजन केंद्रीय परमाणु है क्योंकि यह अधिक संख्या में बंधन बनाता है (दो, क्योंकि यह वीआईए परिवार से संबंधित है);
ऑक्सीजन और हाइड्रोजन के बीच दो एकल बंधन। ऐसा इसलिए है क्योंकि प्रत्येक हाइड्रोजन केवल एक बंधन और ऑक्सीजन दो बंधन बना सकता है;
ऑक्सीजन में चार नॉन-बॉन्डिंग इलेक्ट्रॉन, क्योंकि इसमें वैलेंस शेल में छह इलेक्ट्रॉन होते हैं और बॉन्ड में केवल दो का उपयोग करते हैं।
इसलिए, जैसे पानी के अणु में केंद्रीय परमाणु में तीन परमाणु और चार इलेक्ट्रॉनिक बादल (दो एकल बंधन और गैर-बंधन इलेक्ट्रॉनों के दो जोड़े) होते हैं, ज्यामिति कोणीय है.
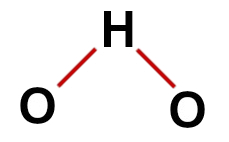
पानी का सही संरचनात्मक सूत्र
ध्यान दें: जब भी अणु इन पैटर्नों को प्रस्तुत करता है, परमाणुओं के बीच बनने वाला कोण लगभग 109º 28. होता है'.
दूसरा उदाहरण: सल्फर डाइऑक्साइड (SO .)2)

सल्फर डाइऑक्साइड की पारंपरिक संरचना
सल्फर डाइऑक्साइड की संरचना में, हमारे पास है:
तीन परमाणु: दो ऑक्सीजन और एक सल्फर परमाणु;
सल्फर केंद्रीय परमाणु है क्योंकि यह अणु में सबसे छोटा तत्व है, क्योंकि सभी तत्वों को समान संख्या में बंधन (दो) बनाने की आवश्यकता होती है;
सल्फर और ऑक्सीजन में से एक के बीच एक दोहरा बंधन। ऐसा इसलिए है क्योंकि दोनों को दो कनेक्शन चाहिए;
एक समन्वय या मूल सहसंयोजक बंधन, क्योंकि सल्फर अन्य ऑक्सीजन के साथ युग्मित करने के बाद स्थिर था, लेकिन अभी भी एक ऑक्सीजन परमाणु को दो इलेक्ट्रॉनों की आवश्यकता है;
ऑक्सीजन में चार गैर-बाध्यकारी इलेक्ट्रॉन। ऐसा इसलिए है क्योंकि ऑक्सीजन के वैलेंस शेल में छह इलेक्ट्रॉन होते हैं और बांड में केवल दो का उपयोग करते हैं।
इस प्रकार, सल्फर डाइऑक्साइड अणु के रूप में, केंद्रीय परमाणु में तीन परमाणु और चार इलेक्ट्रॉनिक बादल (दो एकल बंधन और गैर-बंधन इलेक्ट्रॉनों के दो जोड़े) होते हैं, ज्यामिति कोणीय है.
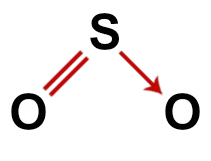
सल्फर डाइऑक्साइड का सही संरचनात्मक सूत्र
ध्यान दें: जब भी अणु में ये पैटर्न होते हैं, परमाणुओं के बीच बनने वाला कोण लगभग 120. होता हैहे.
मेरे द्वारा डिओगो लोपेज डायस
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-geometria-angular.htm

