एन्ट्रापी एक है महानताऊष्मप्रवैगिकी सम्बंधित अपरिवर्तनीयता एक भौतिक प्रणाली के राज्यों के। यह आमतौर पर "की डिग्री के साथ जुड़ा हुआ है"विकार"या"अनियमितता"एक प्रणाली का। के एक कथन के अनुसार ऊष्मप्रवैगिकी का दूसरा नियम:
“एक ऊष्मीय रूप से पृथक प्रणाली में, एन्ट्रापी का माप हमेशा समय के साथ बढ़ना चाहिए, जब तक कि यह अपने अधिकतम मूल्य तक नहीं पहुंच जाता। ”
दूसरे शब्दों में, एन्ट्रापी के अर्थ को मापने में सक्षम है "समय का तीर"एक प्रणाली का। जब हम नीचे की छवियों को देखते हैं, तो हम सहज रूप से जानते हैं कि सिस्टम की प्रारंभिक स्थिति को छवि द्वारा दर्शाया गया है by बाएं, महानतम का संगठन:
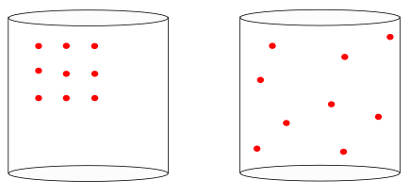
पिछली छवि को देखते हुए, हम जानते हैं कि सबसे संभावित अंतिम विन्यास वह है जिसमें परमाणुओं का होता है सभी दिशाओं में गति, साथ ही साथ यादृच्छिक स्थिति. एंट्रॉपी यही सब के बारे में है: a बहुलता एक प्रणाली के राज्यों की हमेशा बढ़ना चाहिए.
उदाहरण
नीचे दी गई सेटिंग्स में से कौन सी है अधिक संभावित समय के साथ ईंट की व्यवस्था के लिए क्या देखा जाना चाहिए?

पहले विन्यास में, बहुलता प्रखंडों के राज्यों की है थोड़ा: वे सभी में व्यवस्थित हैं
दिशाक्षैतिज, समानांतर एक दूसरे। समय बीतने या एजेंट की कार्रवाई के साथ, यह उम्मीद की जाती है कि इसका विन्यास बड़े हो में संख्या में राज्य अमेरिका, के पक्ष में सोमवाररचना, दाईं ओर की छवि में दिखाया गया है। अन्य उदाहरण दिए जा सकते हैं:जब एक आइस पैक को कंटेनर में रखा जाता है बड़ातापमान, इसका तापमान तब तक बढ़ता है जब तक यह थर्मल बैलेंस. उस समय, बर्फ पिघल सकती है। आइस ब्लॉक से फिर से गर्मी लेकर, जो अभी राज्य में है तरल, यह फिर से ठोस हो सकता है, लेकिन इसकी रचना एक ही संगठन नहीं होगा जो पूर्व में प्रस्तुत किया गया था।
इत्र की बोतल खोलते समय, गर्मी मदद कर सकती है प्रसार आपके अणु, एक कमरे की पूरी लंबाई में इत्र की सामग्री फैलाना। इसके विपरीत की उम्मीद नहीं की जा सकती, क्योंकि गर्मी को हटाने से अणुओं की फ्लास्क में वापसी को बढ़ावा नहीं मिलेगा।
एंट्रोपी की गणितीय परिभाषा
गणितीय परिभाषा ऊष्मा की मात्रा के अनुपात द्वारा एन्ट्रापी दी जाती है (क्यू) एक थर्मली इंसुलेटेड सिस्टम के दो हिस्सों के बीच स्थानांतरित, in जूल (जे), इसके पूर्ण तापमान से, in केल्विन (क):

रों = एन्ट्रॉपी (जे/के)
क्यू = ऊष्मा की मात्रा (J)
टी = पूर्ण तापमान (के)
ऊपर दी गई परिभाषा के लिए मान्य है valid इज़ोटेर्मल प्रक्रियाएंयानी, जिसमें हीट एक्सचेंज इतने छोटे (या धीमे) होते हैं कि वे सिस्टम के तापमान को बदलने में सक्षम नहीं होते हैं। इसलिए एन्ट्रापी की परिभाषा है बहुत छोता (असीम छोटा हिस्सा)।
हम एन्ट्रापी की अवधारणा को इस प्रकार भी समझ सकते हैं: एक ही गैस के दो भागों द्वारा गठित एक प्रणाली होने के नाते, में बहुत अलगतापमान, कुछ राशि निकालना संभव है काम क उसका कुछ चल रहा है पिस्टन या हैंड क्रैंक, उदाहरण के लिए। हालाँकि, अधिक समय तक, इस गैस के भागों की प्रवृत्ति होगी संतुलनथर्मल। चूंकि अब तापमान में कोई अंतर नहीं है, यहां तक कि वहां मौजूद सारी ऊर्जा के साथ भी, किसी भी को निकालना संभव नहीं होगा काम कउपयोगी उसके पास से।
राफेल हेलरब्रॉक द्वारा
भौतिकी में स्नातक
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-entropia.htm

