रासायनिक गतिकी एक ऐसा क्षेत्र है जो रासायनिक प्रतिक्रियाओं के विकास की दर को प्रभावित करने वाले कारकों का अध्ययन करता है, अर्थात जिस गति से वे होते हैं। इस क्षेत्र में अधिक से अधिक शोध हो रहे हैं, क्योंकि हम अक्सर कुछ प्रतिक्रियाओं को तेज करना चाहते हैं या दूसरों को धीमा करना चाहते हैं। यह उद्योगों के लिए विशेष रूप से महत्वपूर्ण है और इस शोध के महत्वपूर्ण तकनीकी परिणाम हैं।
लेकिन चूंकि एक प्रतिक्रिया की गति हर समय अंतराल पर और एक पदार्थ से दूसरे पदार्थ में भिन्न हो सकती है, यह गणना करने के लिए प्रथागत है औसत प्रतिक्रिया गति.
निम्नलिखित सामान्य प्रतिक्रिया पर विचार करें, जिसमें गुणांक छोटे अक्षर होते हैं और अभिकारकों और उत्पादों को बड़े अक्षरों द्वारा दर्शाया जाता है:
ए ए + बी बी → सी सी + डी डी
इस प्रतिक्रिया की औसत गति दी जाएगी रासायनिक समीकरण में किसी एक प्रतिक्रियाशील पदार्थ की प्रतिक्रिया की औसत दर या किसी एक उत्पाद के बनने की औसत दर को उसके संबंधित गुणांक से विभाजित करना। यह द्वारा दिया गया है:
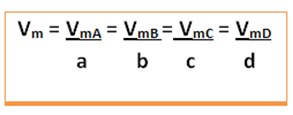
उदाहरण के लिए, हाइड्रोजन पेरोक्साइड अपघटन प्रतिक्रिया पर विचार करें:
2 घंटे2हे2(एक्यू) → 2 एच2हे(1) +1 ओ2 (जी)
मान लीजिए कि 1 मिनट में H का 0.3 mol/L बन गया2O और 0.15 mol/L of O2, जबकि 0.3 mol/L का H विघटित हो गया2हे2अर्थात् अभिक्रिया में इन पदार्थों के अपघटन और बनने की औसत दर है:
वीएमएच2ओ2 = ०.३ मोल/ली. मिनट
वीएमएच2ओ = ०.३ मोल/ली. मिनट
वीएमओ2 = ०.१५ मोल/ली. मिनट
वैश्विक प्रतिक्रिया की औसत गति इनमें से किसी एक मान को लेकर समीकरण में संबंधित गुणांक से विभाजित करके ज्ञात की जाएगी:
वीम = वीएमएच2ओ2 = 0.3 मोल / एल। मिनट = 0.15 मोल/ली. मिनट
2 2
वीम = वीएमएच2ओ = 0.3 मोल / एल। मिनट = 0.15 मोल/ली. मिनट
2 2
वीम = वीएमओ2 = 0.15 मोल/ली. मिनट = 0.15 मोल/ली. मिनट
1 1
ध्यान दें कि तीन मान समान हैं, इसलिए, प्रतिक्रिया दर एक ही समय अंतराल में किसी भी अभिकारक या उत्पाद के कार्य के समान होती है।
हालाँकि, इन प्रतिक्रियाओं में शामिल प्रत्येक पदार्थ के औसत वेग के मान कैसे पाए गए?
इसकी गणना की जा सकती है समय अंतराल से पदार्थ (अभिकर्मक या उत्पाद) की सांद्रता में भिन्नता को विभाजित करना। अगर हम इनमें से किसी एक की औसत गति निर्धारित करने जा रहे हैं अभिकर्मकों प्रतिक्रिया के लिए, हमें a डालना होगा नकारात्मक संकेत पहले, या फिर एकाग्रता मूल्य पर विचार करें मॉड्यूल में ||, चूँकि समय के साथ अभिकारक की सांद्रता घटती जाती है, इसलिए वेग मान ऋणात्मक होगा, लेकिन कोई ऋणात्मक वेग नहीं है।

उदाहरण के लिए, निम्नलिखित ओजोन गैस अपघटन प्रतिक्रिया पर विचार करें (O3 (जी)) ऑक्सीजन गैस में (O .)2(जी)):
2 ओ3 (जी) → 3 ओ2(जी)
बता दें कि एक गुब्बारे में ओजोन गैस के 10 मोल थे, लेकिन 1 मिनट के बाद 4 मोल ही बचे थे; इसका मतलब है कि ओजोन के 6 मोल ऑक्सीजन गैस में बदल गए। तो हमारे पास:
2 ओ3 (जी) → 3 ओ2(जी)
t = 0 मिनट 2 mol/L 0 mol/L
खर्च का गठन
6 मोल / एल 9 मोल / एल
t = 1 मिनट 4 mol/L 9 mol/L
ध्यान दें कि चूंकि प्रतिक्रिया अनुपात 2:3 है, तो यदि O के 6 मोल का उपयोग किया गया था3, O के 9 mol बनते हैं2. तो, 1 मिनट के बाद, हमारे पास निम्न औसत गति है:
वीम = - [द3]
तो
वीम = - ([ओ3फाइनल - हे3प्रारंभिक])
तोअंतिम - टीप्रारंभिक
वीम = - ([4 - 10])
1– 0
वीम = 6 मोल/ली. मिनट→ 1 मिनट के लिए, सिस्टम के प्रत्येक लीटर में 6 mol ओजोन प्रतिक्रिया करता है।
वीम = [द2]
तो
वीम = ([ओ2फाइनल - हे2प्रारंभिक])
तोअंतिम - टीप्रारंभिक
वीम = ([9 - 0])
1– 0
वीम = 9 मोल/ली. मिनट→ 1 मिनट के दौरान तंत्र के प्रत्येक लीटर में 9 मोल ऑक्सीजन का निर्माण हुआ।
इससे हमें पता चलता है कि हम अभिकारकों के फलन के रूप में या उत्पादों के फलन के रूप में औसत वेग की गणना कर सकते हैं।
अब, यदि हम इस वैश्विक प्रतिक्रिया की औसत गति की गणना करना चाहते हैं, तो जैसा हमने शुरुआत में दिखाया था, वैसा ही करें: इनमें से प्रत्येक गति को रासायनिक समीकरण में उनके संबंधित गुणांक से विभाजित करें:
वीम = वीएमओ3 = 6 मोल/ली. मिनट = 3 मोल / एल। मिनट
2 21
वीम = वीएमओ2 = 9 मोल/ली. मिनट = 3 मोल / एल। मिनट
3 3
वीम = वीएमओ3 = वीएमओ2
23
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/quimica/velocidade-das-reacoes-quimicas.htm

