अष्टक सिद्धांत कहता है कि किसी रासायनिक तत्व के परमाणु के स्थिर होने के लिए, उसे एक उत्कृष्ट गैस का इलेक्ट्रॉनिक विन्यास प्राप्त करना होगा, यानी, यदि परमाणु में केवल पहला इलेक्ट्रॉन शेल है, तो उसके वैलेंस शेल में आठ इलेक्ट्रॉन होने चाहिए या दो इलेक्ट्रॉन होने चाहिए। (क)।
बेरिलियम की परमाणु संख्या 4 के बराबर होती है। इसलिए, आपके परमाणु में 4 इलेक्ट्रॉन हैं और जमीनी अवस्था में इसका इलेक्ट्रॉनिक वितरण निम्नानुसार है:

बेरिलियम इलेक्ट्रॉनिक विन्यास
इसका मतलब है कि बेरिलियम के अंतिम कोश में 2 इलेक्ट्रॉन होते हैं, जो 2A परिवार (क्षारीय पृथ्वी धातु) से होता है। इस प्रकार, यह इन दो इलेक्ट्रॉनों को दान करने की प्रवृत्ति रखता है, चार्ज 2+ प्राप्त करता है, अर्थात इसमें आयनिक बंधन बनाने की प्रवृत्ति होगी।
हालांकि, यह देखा गया है कि बेरिलियम परमाणु सहसंयोजक बंधन बनाते हैं, इलेक्ट्रॉन साझाकरण के साथ, जैसा कि नीचे बने यौगिक में दिखाया गया है, बेरिलियम हाइड्राइड (बीएचएच)2):
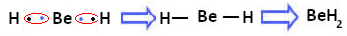
हाइड्रोजन के साथ बेरिलियम के सहसंयोजक बंधों का निर्माण
ध्यान दें कि, इस मामले में, बेरिलियम अपने वैलेंस शेल में आठ से कम इलेक्ट्रॉनों के साथ स्थिर है, क्योंकि अपने इलेक्ट्रॉनों को हाइड्रोजन परमाणुओं की तरह साझा करें, अब इसके अंतिम में चार इलेक्ट्रॉन हैं परत। इसलिए, यह एक. है
अष्टक नियम के अपवाद.लेकिन सहसंयोजक बंधन आमतौर पर होता है क्योंकि तत्व में अपूर्ण कक्षाएँ होती हैं। उदाहरण के लिए, जैसा कि नीचे दिखाया गया है, हाइड्रोजन का कक्षक अधूरा है, इसलिए यह केवल एक सहसंयोजक बंधन बनाता है। ऑक्सीजन के दो अपूर्ण कक्षक होते हैं और यह दो सहसंयोजी बंध बनाता है। बदले में, नाइट्रोजन के तीन अपूर्ण कक्षक होते हैं और फलस्वरूप, तीन सहसंयोजक बंध बनाता है:
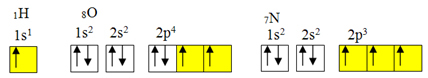
हाइड्रोजन, ऑक्सीजन और नाइट्रोजन का इलेक्ट्रॉनिक वितरण
हालांकि, जैसा कि पहले ही दिखाया गया है, बेरिलियम में अपूर्ण कक्षाएँ नहीं होती हैं।
तो यह सहसंयोजक बंधन क्यों बनाता है?
स्पष्टीकरण में है संकरण सिद्धांत, जो कहता है कि जब एक कक्षक से एक इलेक्ट्रॉन ऊर्जा प्राप्त करता है, तो वह सबसे बाहरी खाली कक्ष में "कूद" जाता है, उत्तेजित अवस्था में रहना और इस प्रकार अधूरे परमाणु कक्षकों का संलयन या मिश्रण होता है, उत्पादक संकर कक्षक जो एक दूसरे के समतुल्य हैं और मूल शुद्ध कक्षकों से भिन्न हैं।
उदाहरण के लिए, बेरिलियम के मामले में, सबलेवल 2s से एक इलेक्ट्रॉन ऊर्जा प्राप्त करता है और एक सबलेवल 2p ऑर्बिटल में जाता है जो खाली था:

हाइब्रिड ऑर्बिटल्स के निर्माण के लिए बेरिलियम उत्तेजित अवस्था
इस तरह, बेरिलियम में दो अधूरे ऑर्बिटल्स होते हैं, जो दो सहसंयोजक बंधन बनाने में सक्षम होते हैं।
ध्यान दें कि एक कक्षक एक "s" उपस्तर में है और दूसरा "p" में है, इसलिए बेरिलियम जो बंधन करेगा वह अलग होना चाहिए। हालाँकि, ऐसा नहीं होता है, क्योंकि की घटना के साथ संकरण, बनने वाले ये अधूरे ऑर्बिटल्स मिश्रित होंगे, जिससे दो ऑर्बिटल्स उत्पन्न होंगे जिन्हें. कहा जाता है संकर या संकरित, जो एक दूसरे के बराबर हैं। इसके अलावा, चूंकि ये दो हाइब्रिड ऑर्बिटल्स "s" ऑर्बिटल और "p" ऑर्बिटल से आए हैं, इसलिए हम कहते हैं कि यह हाइब्रिडाइजेशन टाइप का है। एसपी:

बेरिलियम सपा संकरण गठन
चूंकि हाइब्रिड ऑर्बिटल्स समान हैं, बेरिलियम हाइड्रोजन परमाणुओं के साथ जो सहसंयोजक बंधन बनाता है वह भी समान होगा:

हाइड्रोजन के एस ऑर्बिटल्स के साथ हाइब्रिड बेरिलियम ऑर्बिटल्स का इंटरपेनेट्रेशन
ध्यान दें कि यह तब दो सिग्मा बांड बनाता है जो कि प्रकार के होते हैं s-sp (σ .)एस-एसपी).
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/quimica/hibridizacao-berilio.htm

