यदि किसी धातु की संरचना की स्पष्ट रूप से कल्पना करना संभव होता, तो हम इसे ऊपर की छवि के रूप में देखते। धातुओं की परमाणु संरचना क्रिस्टलीय होती है, जिसमें इलेक्ट्रॉनों से घिरे धातु के धनायन होते हैं।
धातुओं में मौजूद क्रिस्टलीय जाली को निम्नानुसार दर्शाया जा सकता है: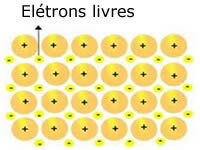
धात्विक सोडियम (Na) का प्रतिनिधित्व
धातुओं के क्रिस्टलीय जालक स्थिर धनायनों के समूह द्वारा बनते हैं।
प्रत्येक Na+ धनायन इलेक्ट्रॉनों से घिरा होता है, लेकिन ये निरूपित होते हैं, अर्थात ये किसी भी नाभिक की ओर आकर्षित नहीं होते हैं।
चूंकि ऋणात्मक आवेशों (इलेक्ट्रॉन) और धनात्मक नाभिक (धनायन) के बीच कोई आकर्षण नहीं होता है, मुक्त इलेक्ट्रॉन धातु के पूरे क्रिस्टलीय जाली पर कब्जा कर लेते हैं। इलेक्ट्रॉनों को स्थानांतरित करने की स्वतंत्रता उन्हें एक इलेक्ट्रॉनिक बादल बनाने का कारण बनती है।
इस बादल की उपस्थिति से धातुओं की विद्युत प्रवाहित करने की क्षमता को समझाया गया है। अन्य धातुओं के साथ मुक्त इलेक्ट्रॉनों के संपर्क से विद्युत प्रवाह उत्पन्न होता है।
सोडियम (Na), गोल्ड Au, कॉपर (Cu) जैसी धातुओं सहित किसी भी परमाणु की संरचना में एक संयोजकता परत होती है। इस परत के माध्यम से इलेक्ट्रॉन स्वतंत्र रूप से चलते हैं, जिससे धनायनों के लिए विद्युत चुम्बकीय आकर्षण बना रहता है। यह संरचनात्मक गुण धातु के अणुओं के निर्माण की अनुमति देता है और, परिणामस्वरूप, स्वयं धातुओं का।
लिरिया अल्वेस द्वारा
रसायन विज्ञान में स्नातक
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/quimica/como-se-forma-ligacao-metalica.htm


