बैटरी एक प्रणाली है जहां ऑक्सीकरण-कमी प्रतिक्रिया होती है। इस उपकरण में, स्वतःस्फूर्त प्रतिक्रिया में उत्पन्न रासायनिक ऊर्जा विद्युत ऊर्जा में परिवर्तित हो जाती है।
एक सेल में ऑक्सीकरण और कमी प्रतिक्रियाएं एक साथ होती हैं। जब एक प्रजाति ऑक्सीकरण से गुजरती है, तो यह अन्य प्रजातियों को इलेक्ट्रॉनों का दान करती है, जो उन्हें प्राप्त करने पर कम हो जाती है।
इसलिए, जो ऑक्सीकरण से गुजर रहा है वह कम करने वाला एजेंट है और जो कम हो रहा है वह ऑक्सीकरण एजेंट है।
ऑक्सीकरण तब होता है जब एक प्रजाति इलेक्ट्रॉनों को खो देती है और एक धनायन बन जाती है: A → A+ + और-.
कमी तब होता है जब एक प्रजाति इलेक्ट्रॉन प्राप्त करती है और विद्युत रूप से तटस्थ हो जाती है: B+ + और- → बी.
रासायनिक समीकरणों में, यह इलेक्ट्रॉन स्थानांतरण ऑक्सीकरण संख्या (nox) में परिवर्तन द्वारा प्रदर्शित किया जाता है।
कोशिकाओं के अंदर अपचयन अभिक्रियाएँ होती हैं और इलेक्ट्रॉनों के ऋणात्मक से धनात्मक ध्रुव की ओर प्रवास के साथ विद्युत धारा उत्पन्न होती है।

स्टैक कैसे काम करता है?
एक रेडॉक्स प्रतिक्रिया आम तौर पर समीकरण द्वारा दर्शाया जा सकता है:
ए + बी+ → ए+ + बी
कहाँ पे,
ए: पदार्थ जो ऑक्सीकृत होता है, इलेक्ट्रॉनों को खो देता है, उसका मूल्य बढ़ाता है और कम करने वाला एजेंट होता है।
B: पदार्थ जो अपचयन से गुजरता है, इलेक्ट्रॉनों को ग्रहण करता है, ऑक्सीकरण को कम करता है और ऑक्सीकारक है।
निम्न छवि में देखें कि इस प्रक्रिया का प्रतिनिधित्व कैसे किया जा सकता है।
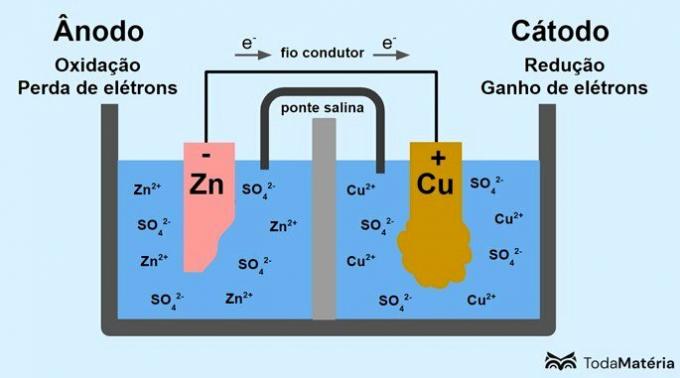
प्रणाली को दो अर्ध-कोशिकाओं में विभाजित किया गया और एक संवाहक तार द्वारा बाहरी रूप से जुड़े दो धात्विक इलेक्ट्रोडों द्वारा निर्मित, जॉन फ्रेडरिक डेनियल (1790-1845) द्वारा 1836 में विकसित किया गया था।
बैटरी में दो इलेक्ट्रोड होते हैं, जो एक संवाहक तार से जुड़े होते हैं, और एक इलेक्ट्रोलाइट, जहां आयन होते हैं। इलेक्ट्रोड ठोस संवाहक सतह है जो इलेक्ट्रॉनों के आदान-प्रदान की अनुमति देता है।
एनोड: इलेक्ट्रोड जिस पर ऑक्सीकरण होता है। यह बैटरी का नेगेटिव पोल भी है।
कैथोड: इलेक्ट्रोड जिस पर कमी होती है। यह बैटरी का धनात्मक ध्रुव भी है।
ऊपर की छवि में, धात्विक जस्ता एनोड है और से गुजरता है ऑक्सीकरण. धात्विक तांबा कैथोड है और अपचयन से गुजरता है। इलेक्ट्रॉनों का प्रवासन (ई-) एनोड से कैथोड तक प्रवाहकीय तार के माध्यम से होता है।
छवि प्रणाली में होने वाली प्रतिक्रियाएं हैं:
- एनोड (ऑक्सीकरण): Zn(एस) → जेडएन2(यहां) + 2e-
- कैथोड (कमी): Cu2+(यहां) + 2e- → गधा(एस)
- सामान्य समीकरण: Zn(एस) + गधा2+(यहां) → गधा(एस) + Zn2+(यहां)
जिंक एक धातु है जिसमें इलेक्ट्रॉनों को खोने की अधिक प्रवृत्ति होती है और इसलिए, समाधान में धनायन बनते हैं। जिंक इलेक्ट्रोड खराब होने लगता है और द्रव्यमान खोना शुरू हो जाता है क्योंकि Zn केशन बनाते समय जिंक को घोल में छोड़ा जाता है2+.
एनोड से इलेक्ट्रॉन कैथोड पर पहुंचते हैं और धातु के धनायन प्राप्त करने पर, धातु के तांबे में बदल जाते हैं, जो इलेक्ट्रोड पर जमा होता है और इसके द्रव्यमान को बढ़ाता है।
सॉल्ट ब्रिज एक आयनिक धारा है जो सिस्टम में आयनों के संचलन के लिए जिम्मेदार है ताकि इसे विद्युत रूप से तटस्थ रखा जा सके।
इसके बारे में भी पढ़ें ऑक्सीकरण संख्या (nox).
बैटरी प्रकार
एक सेल में, रासायनिक प्रजातियों की इलेक्ट्रॉनों को प्राप्त करने या दान करने की प्रवृत्ति कमी क्षमता से निर्धारित होती है।
उच्चतम कमी क्षमता वाले घटक में कमी होती है, अर्थात इलेक्ट्रॉनों को प्राप्त करने के लिए। सबसे कम कमी क्षमता वाली प्रजातियां और, परिणामस्वरूप, उच्चतम ऑक्सीकरण क्षमता, इलेक्ट्रॉनों को स्थानांतरित करने की प्रवृत्ति रखती है।
उदाहरण के लिए, रेडॉक्स प्रतिक्रिया में Zn0(एस) + गधा2+(यहां) → गधा0(एस) + Zn2+(यहां)
जिंक इलेक्ट्रॉनों का ऑक्सीकरण और दान करता है क्योंकि इसमें कमी क्षमता ई है0 = -0.76V, कॉपर E. के अपचयन विभव से कम0 = +0.34V और, इसलिए, यह इलेक्ट्रॉनों को प्राप्त करता है और कमी से गुजरता है।
ढेर के अन्य उदाहरणों के लिए नीचे देखें।
जिंक और हाइड्रोजन स्टैक
ऑक्सीकरण अर्ध-प्रतिक्रिया: Zn(एस) → जेडएन2+ + 2e- (तथा0 = -0.76 वी)
कमी आधा प्रतिक्रिया: 2H+(यहां) + 2e- → एच2(जी) (तथा0 = 0.00 वी)
वैश्विक समीकरण: Zn(एस) + 2H+(यहां) → जेडएन2+(यहां) + एच2(जी)
ढेर प्रतिनिधित्व:
कॉपर और हाइड्रोजन सेल
ऑक्सीकरण अर्ध-प्रतिक्रिया: H2(जी) → 2H+(यहां) + 2e- (तथा0 = 0.00 वी)
कमी आधा प्रतिक्रिया: Cu2+(यहां) + 2e- → गधा(एस) (तथा0 = +0.34वी)
वैश्विक समीकरण: Cu2+(यहां) + एच2(जी) → 2H+(यहां) + गधा(एस)
ढेर प्रतिनिधित्व:
सामग्री के साथ विषय पर अधिक जानकारी प्राप्त करें:
- विद्युत रसायन
- इलेक्ट्रोलीज़
ग्रंथ सूची संदर्भ
फोन्सेका, एम. आर। एम रसायन, 2. 1. ईडी। साओ पाउलो: एटिका, 2013।
सैंटोस, डब्ल्यूएलपी; एमओएल, जी.एस. नागरिक रसायन शास्त्र, 3. 2. ईडी। साओ पाउलो: एडिटोरा एजेएस, 2013।
यूएसबीईआरसीओ, जे. कनेक्ट केमिस्ट्री, 2: केमिस्ट्री। - 2. ईडी। साओ पाउलो: सारावा, 2014।



