क्रोम, परमाणु संख्या 24, एक संक्रमण धातु है जो आवर्त सारणी के समूह 6 में स्थित है। इसका रंग भूरा होता है, लेकिन यह बहुत चमकदार धातु भी है। यह मुख्य रूप से +2, +3 और +6 ऑक्सीकरण अवस्थाओं में मौजूद है और इसकी विशेषता है कि इसके सभी यौगिक रंगीन होते हैं। कोई आश्चर्य नहीं कि इसका नाम ग्रीक से निकला है क्रोमा, जिसका अर्थ है रंग।
यह तत्व क्रोमाइट के माध्यम से प्राप्त किया जाता है और स्टेनलेस स्टील और अन्य विशेष मिश्र धातुओं के उत्पादन में धातुकर्म उद्योग में व्यापक रूप से उपयोग किया जाता है। क्रोमियम को वस्तुओं पर इलेक्ट्रोप्लेट किया जा सकता है, क्रोम चढ़ाना के रूप में जाना जाने वाला प्रभाव, जो सुंदरता के अलावा, महान रासायनिक प्रतिरोध की गारंटी देता है। अपवर्तक सामग्री के अलावा, क्रोमियम यौगिकों का उपयोग पिगमेंट और पेंट में भी किया जाता है।
यह भी पढ़ें: हेफ़नियम - संक्रमण धातु जिसमें ज़िरकोनियम के समान गुण होते हैं
क्रोम सारांश
क्रोमियम एक धूसर, चमकदार धातु है जो के समूह 6 को खोलता है आवर्त सारणी.
यह कमरे के तापमान पर जंग और रासायनिक हमले के लिए बहुत प्रतिरोधी है।
यह मुख्य रूप से ऑक्सीकरण अवस्था +2, +3 और +6 प्रस्तुत करता है।
इसके सभी यौगिकों का रंग होता है।
यह क्रोमाइट, FeCr. से प्राप्त किया जा सकता है24.
इसका मुख्य रूप से धातुकर्म उद्योग द्वारा शोषण किया जाता है, जो इसका उपयोग के निर्माण में करता है स्टेनलेस स्टील.
इसकी खोज 1797 में फ्रांसीसी लुई निकोलस वौक्वेलिन ने की थी।
[पुलिसिटी_ओम्निया]
क्रोम गुण
प्रतीक: करोड़।
परमाणु संख्या: 24.
परमाणु भार: 51.9961 घन मीटर
विद्युत ऋणात्मकता: 1,66.
संलयन बिंदु: 1907 डिग्री सेल्सियस।
क्वथनांक: 2671 डिग्री सेल्सियस
घनत्व: 7.15 ग्राम सेमी-3 (20 डिग्री सेल्सियस पर)।
इलेक्ट्रोनिक विन्यास: [वायु] 4s1 3डी5.
रासायनिक श्रृंखला: समूह 6, एमएटिस संक्रमण.
क्रोम विशेषताएं
क्रोमियम, परमाणु क्रमांक 24, है a धातु रंग में ग्रे, कठोर और चमकदार. कमरे के तापमान पर, यह एचसीएल और एच के अपवाद के साथ, अम्लीय या मूल समाधान जैसे रासायनिक हमलों के लिए अच्छी तरह से प्रतिरोध करता है।2केवल4 पतला। हालांकि, उच्च तापमान पर, क्रोमियम अधिक प्रतिक्रियाशील हो जाता है, आसानी से O. द्वारा ऑक्सीकृत हो जाता है2, और हैलोजन और अधिकांश अधातुओं के साथ संयोजित होता है।
समाधान में, क्रोमियम यौगिकों में +6, +3, और +2 की ऑक्सीकरण संख्या होती है। वास्तव में, एक दिलचस्प विशेषता यह है कि सब क्रोमियम यौगिक रंगीन हैं, जैसे का डाइक्रोमेट पोटैशियम, क2करोड़27, जो नारंगी है, और पोटेशियम क्रोमेट, K2सीआरओ4, जो पीला है।
क्रोमियम के बारे में एक जिज्ञासु तथ्य यह है कि इसका इलेक्ट्रॉन विन्यास अपेक्षित पैटर्न का पालन नहीं करता है. अपना बनाना इलेक्ट्रॉनिक वितरण, यह [Ar] 4s. होने की उम्मीद की जाएगी2 3डी4हालांकि, ऊर्जा और स्थिरता की गणना से पता चलता है कि [Ar] 4s विन्यास1 3डी5 यह अधिक स्थिर है। इसे द्वारा समझाया जा सकता है हुंड का नियम.
इस नियम के अनुसार की संख्या जितनी अधिक होगी इलेक्ट्रॉनों एक अधूरे कक्षक में बराबर (या समानांतर) चक्कर लगाने के साथ, की ऊर्जा कम होती है परमाणु, यानी स्थिरता जितनी अधिक होगी। नीचे दी गई छवि को देखें:
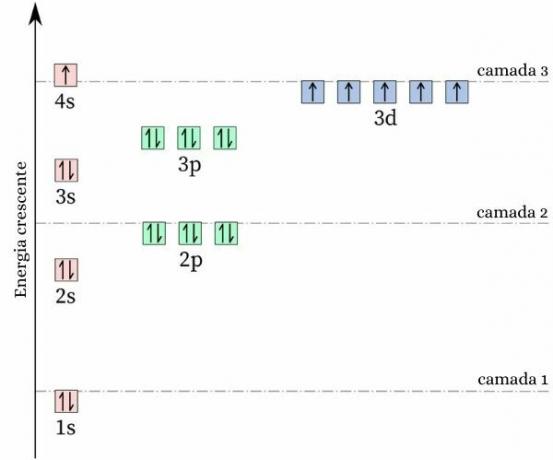
यदि क्रोम ने 4s कॉन्फ़िगरेशन अपनाया है2 3डी4, 4s कक्षक विपरीत स्पिन (↑↓) के साथ इलेक्ट्रॉनों को प्रस्तुत करेगा, जो प्रतिकर्षण को बढ़ाएगा, आखिरकार, एक ही कक्षीय साझा करने वाले एक ही संकेत के दो शुल्क होंगे।
4s विन्यास को अपनाकर1 3डी5, क्रोमियम में समान स्पिन वाले इलेक्ट्रॉनों की अधिक संख्या होती है, समान कक्षीय साझा करने वाले इलेक्ट्रॉनों की उपस्थिति के बिना (जैसा कि पिछली छवि में दिखाया गया है), जो इसकी ऊर्जा को कम करता है और अधिक स्थिरता की गारंटी देता है।
यह भी देखें: वैनेडियम - रासायनिक तत्व जिसके घोल में भी अलग-अलग रंग होते हैं
क्रोमियम कहाँ पाया जाता है?
क्रोम है पृथ्वी पर दसवां सबसे प्रचुर तत्व. हालांकि ऐसे कई खनिज हैं जिनके संविधान में क्रोमियम है, क्रोमाइट, FeCr24, क्रोमियम का सबसे महत्वपूर्ण खनिज है, जिसका व्यावसायिक रूप से सबसे अधिक दोहन किया जाता है।

यह उजागर करना महत्वपूर्ण है कि उच्चतम क्रोमियम भंडार वाले देश हैं:
दक्षिण अफ्रीका;
कजाखस्तान;
भारत;
टर्की.
ब्राज़िल पूरे अमेरिकी महाद्वीप में एकमात्र क्रोमियम उत्पादक है, लेकिन दुनिया के भंडार का केवल 0.11% रखता है। भंडार मुख्य रूप से निम्नलिखित राज्यों में वितरित किए जाते हैं:
बाहिया;
अमापा;
मिना गेरियास.
क्रोम प्राप्त करना

धातु क्रोम का उत्पादन होता है के माध्यम से क्रोमाइट से. इस मामले में, खनिज के साथ पिघलाया जाता है सोडियम कार्बोनेट, पर2सीओ3, हवा की उपस्थिति में, सोडियम क्रोमेट और आयरन III ऑक्साइड उत्पन्न करना:
4 FeCr24 + 8 इंच2सीओ3 + 7 ओ2 → 8 इंच2सीआरओ4 + 2 फे23 + 8 सीओ2
वहां से निष्कर्षण किया जाता है पानी, Na. के बाद से2सीआरओ4 पानी में घुलनशील है, जबकि Fe23 नहीं। फिर, माध्यम को H. के साथ अम्लीकृत किया जाता है2केवल4, जो के क्रोमेट के क्रिस्टलीकरण की अनुमति देता है सोडियम. फिर एक2सीआरओ4 के उपयोग से क्रोमियम III ऑक्साइड में अपचयित हो जाता है कार्बन उच्च तापमान पर:
पर2सीआरओ4 + 2 सी → सीआर23 + पर2सीओ3 + सीओ
धातु क्रोमियम तब प्राप्त होता है जब एल्यूमीनियम को कम करने वाले एजेंट के रूप में उपयोग किया जाता है, वह भी उच्च तापमान पर:
करोड़23 + 2 अल → अल23 + 2 करोड़
क्रोम अनुप्रयोग
उद्योग धातु क्रोमियम का प्रमुख उपभोक्ता है, जिसमें लगभग 80% क्रोमियम का उत्पादन होता है, या तो क्रोमाइट या सीआर सांद्र के रूप में।23. ऐसा इसलिए है क्योंकि क्रोमियम फेरोक्रोम मिश्र धातु बनाने में सक्षम है, जो प्राप्त करने का मूल स्रोत है स्टेनलेस स्टील और अन्य विशेष मिश्र धातु.
क्रोमियम, जो आमतौर पर स्टेनलेस स्टील का 18% बनाता है, स्टील पर ऑक्सीकरण (जंग) और अन्य रासायनिक हमलों के प्रतिरोध को काफी बढ़ाता है। अन्य विशेष मिश्र धातुओं में, क्रोमियम सामग्री की कठोरता, कठोरता और कठोरता को बढ़ाने में भी भूमिका निभाता है।

आग रोक उद्योग यह क्रोमियम का भी एक अच्छा उपभोक्ता है, क्योंकि क्रोमाइट एक प्रसिद्ध दुर्दम्य सामग्री है, जो कि उद्योगों में होने वाले थर्मल, रासायनिक और भौतिक प्रभावों को झेलने में सक्षम सामग्री है। आग रोक ईंटों के निर्माण के लिए इस्तेमाल किया जाने वाला क्रोमाइट, हीटिंग के संपर्क में आने पर क्षरण के लिए बहुत प्रतिरोधी है।
पहले से ही रासायनिक उद्योग कई तरह से क्रोम का उपयोग करना चाहता है:
उत्प्रेरक के रूप में;
संक्षारण अवरोधक के रूप में;
क्रोम चढ़ाना में;
पिगमेंट में;
रंगाई यौगिकों में।
क्रोम चढ़ाना अच्छी तरह से जाना जाता है, जिसमें किसी वस्तु पर क्रोमियम की एक सुरक्षात्मक परत का निर्माण होता है, जो इसे जंग से बचाता है। इस प्रक्रिया में, क्रोम को क्रोम किए जाने वाली वस्तु पर जमा किया जाता है इलेक्ट्रोलीज़ क्रोमियम III सल्फेट, Cr2(केवल4)3, Cr. के विघटन द्वारा निर्मित23 एच में2केवल4.
क्रोमियम वर्णक बहुत आम हैं, विशेष रूप से विभिन्न रंगों के साथ जो उनके यौगिकों से प्राप्त किए जा सकते हैं। क्रोमियम III क्लोराइड हेक्साहाइड्रेट के विघटन में, CrCl3·सुबह 6 बजे2O, एक बैंगनी विलयन प्राप्त होता है। दूसरी ओर, क्रोमियम III सल्फेट के विघटन में, Cr2(केवल4)3, हरा रंग प्राप्त होता है।
क्रोमियम II क्लोराइड का घोल, CrCl2, नीला है, जबकि क्रोमियम II एसीटेट, Cr2(सीओओ)4, एक लाल ठोस है। क्रोमियम ऑक्साइड II, CrO2, यह काला है; पोटेशियम क्रोमेट, K2सीआरओ4, और पीला; पोटेशियम डाइक्रोमेट, K2करोड़27, और नारंगी; पोटेशियम ट्राइक्रोमेट, K2करोड़310, यह लाल हो गया है; और क्रोमियम VI ऑक्साइड, CrO3, लाल भी है।
दिलचस्प:माणिक वास्तव में रत्न हैं, सूत्र Al. के23, जिनके संविधान में क्रोमियम के निशान हैं। यह पन्ना के मामले में भी है, बेरिल का एक रूप, जिसका हरा रंग क्रोमियम की थोड़ी मात्रा का परिणाम है।
यह भी पता है:टंगस्टन - एक धूसर धातु जिसका रंग स्टील जैसा दिखता है
क्रोमियम का स्वास्थ्य से संबंध
क्रोमियम की दो ऑक्सीकरण अवस्थाओं की जैविक भूमिका होती है। आइए आगे देखते हैं।
→ हेक्सावलेंट क्रोमियम (Cr .)6+)
Cr. के संबंध में6+, यह ज्ञात है कि यह हो सकता है कार्सिनोजेनिक माना जाता है, खासकर अगर बड़ी मात्रा में साँस या अंतर्ग्रहण।
→ त्रिसंयोजक क्रोमियम (Cr .)3+)
त्रिसंयोजक क्रोमियम हमेशा से रहा है माना एक आवश्यक तत्व. इस रूप में क्रोमियम का पोषण पूरक आवश्यक ट्रेस तत्व संवर्धन और वजन घटाने वाले एजेंट के रूप में लोकप्रिय हो गया है। चर्चा यह भी है कि ट्रिटेंट क्रोमियम का प्रशासन किसके उपचार के लिए दिलचस्प होगा? मधुमेह प्रकार 2, साथ ही गर्भावधि मधुमेह के लिए।
यद्यपि, कुछ लेखकों ने कहा चर्चा के तहत यह अनिवार्यता. विचार की रेखा यह है कि क्रोमियम, पूरक हो या न हो, शरीर की संरचना पर कोई फर्क नहीं पड़ता, उपापचय देता है शर्करा या इंसुलिन संवेदनशीलता। यह माना जाता है कि, वास्तव में, क्रोमियम की उच्चतम खुराक में एक आवश्यक तत्व के रूप में इंगित करने के लिए औषधीय और गैर-पोषक प्रभाव होते हैं।
क्रोम इतिहास
क्रोमियम नाम ग्रीक से आया है क्रोमा, जिसका अर्थ है रंग। इस तत्व को भी नाम देकर, इसकी खोज के बारे में आयाफ्रांसीसी फार्मासिस्ट और रसायनज्ञ लुई निकोलस वौक्वेलिन, वर्ष 1797 में, जब उन्होंने क्रोकोइट अयस्क, PbCrO का अध्ययन करते समय क्रोमियम पर ध्यान दिया4. हालांकि, शुरू में, धातु एक बड़ी व्यावसायिक सफलता नहीं थी।
इसकी खोज के पंद्रह साल बाद, उदाहरण के लिए, सर हम्फ्री डेवी क्रोमियम और इसके यौगिकों के बारे में ज्यादा नहीं जानते थे जब उन्होंने अपनी प्रसिद्ध पुस्तक लिखी थी रासायनिक दर्शन के तत्व, केवल यह दर्शाता है कि क्रोमिक एसिड का स्वाद खट्टा था।
उसी वर्ष, जॉन्स जैकब बर्ज़ेलियस ने लिखा कि जहरीले क्रोमिक एसिड का स्वाद अप्रिय और धातु था। बर्ज़ेलियस ने महसूस किया कि धातु, हालांकि भंगुर है, की कार्रवाई के लिए काफी प्रतिरोधी थी अम्ल और वायुमंडलीय हवा।
हालांकि शुरू में एक बड़ी व्यावसायिक सफलता नहीं थी, 19वीं सदी के अंत और 20वीं सदी की शुरुआत में, तत्व व्यावसायिक उपयोग होने लगा, चूंकि स्टेनलेस स्टील का व्यापक रूप से उपयोग किया जाने लगा, साथ ही मोटर वाहन उद्योग में भागों की क्रोम चढ़ाना, क्रोम को बड़ी मांग में धातु बना दिया।
क्रोमियम हल किए गए व्यायाम
प्रश्न 1
(यूईएफएस/बीए)क्रोमियम परमाणु की प्रजातियों में ऑक्सीकरण संख्या +3 है
ए) सीआर23
बी) सीआरओ
सी) सीआर
डी) सीआरओ42-
ई) करोड़272-
संकल्प:
वैकल्पिक ए
C अक्षर में, क्रोमियम एक साधारण पदार्थ के रूप में दिखाई देता है, इसलिए, उस स्थिति में, NOx शून्य के बराबर है।
ऑक्सीजन अन्य यौगिकों में यह -2 के बराबर NOx के साथ होता है। इस प्रकार, हम सभी प्रजातियों में क्रोमियम के NOx की गणना कर सकते हैं, जिससे यह अज्ञात (x) हो जाएगा:
करोड़23 → 2x + 3(-2) = 0 x = +3
सीआरओ → एक्स + (-2) = 0 ⸫ एक्स = +2
सीआरओ42- → x + 4(-2) = -2 ⸫ x = +6
Cr2O72- → 2x + 7(-2) = -2 ⸫ x = +6
प्रश्न 2
(यूपीई 2013) वैज्ञानिकों के एक अंतरराष्ट्रीय समूह ने एक जटिल रासायनिक प्रतिक्रिया की खोज की है जो इनमें से कुछ के बिगड़ने के लिए जिम्मेदार है विंसेंट वैन गॉग (1853-1890) और 20वीं सदी के अन्य प्रसिद्ध चित्रकारों द्वारा निर्मित इतिहास में कला के महान कार्य XIX. अपनी जांच में, इन शोधकर्ताओं ने पिगमेंट को कृत्रिम रूप से वृद्ध किया और पाया कि ऊपरी परत का काला पड़ना पेंट में मौजूद क्रोमियम के Cr(VI) से तक के परिवर्तन से संबंधित था सीआर (III)।
में उपलब्ध: http://agencia.fapesp.br/13455 (अनुकूलित)
जानकारी:Cr (Z = 24), इलेक्ट्रॉनिक विन्यास: [Ar] 4s1 3डी5
ऊपर वर्णित स्थिति को देखते हुए, यह है सहीदावा करें कि (द)
ए) सीआर (VI) से सीआर (III) के ऑक्सीकरण ने इतिहास में महान कलात्मक कार्यों को खराब कर दिया है।
बी) फ्रेम की उम्र बढ़ने का संबंध Cu. के इलेक्ट्रॉनिक उत्तेजना से है Cr. के लिए3+.
सी) सीआर कमी प्रक्रिया6+ Cr. के लिए3+ उन्नीसवीं शताब्दी के प्रसिद्ध कार्यों को अस्पष्ट कर दिया है।
डी) जो परिवर्तन हुआ है, उसने Cu. का ऑक्सीकरण किया है, मूल पेंटिंग की चमक के लिए जिम्मेदार।
E) Cr(VI) से Cr(III) में परिवर्तन एक रासायनिक प्रतिक्रिया है जो कई वर्षों के बाद ही होती है।
संकल्प:
वैकल्पिक सी
Cr(VI) से Cr(III) में संक्रमण किसकी प्रक्रिया है? कमी (एनओएक्स में कमी), जो स्क्रीन के काले पड़ने के लिए जिम्मेदार था।
स्टेफ़ानो अराउजो नोवाइस द्वारा
रसायन विज्ञान शिक्षक


