तत्वों का आवधिक वर्गीकरण 1913 में हेनरी मोंसेले (1887-1915) द्वारा प्रस्तावित किया गया था, जिन्होंने कई की आवधिक भिन्नता की पहचान की थी एक तत्व के परमाणु के नाभिक में प्रोटॉन की संख्या के अनुसार नियमित अंतराल पर गुण रासायनिक।
जिस वजह से आवधिकता का नियम, वर्तमान आवर्त सारणी के तत्वों को व्यवस्थित करने के लिए प्रयुक्त मानदंड परमाणु संख्या (Z) का आरोही क्रम है।
118 रासायनिक तत्वों को आवर्त सारणी के समूहों और आवर्तों में व्यवस्थित किया गया है। भौतिक और रासायनिक गुणों के अनुसार, इनमें अंतर करना संभव है धातुओं, अधातु (अधातु) और अर्धधातु (मेटलॉइड्स)।

लंबवत रेखाएं हैं 18 समूह तालिका और समान रासायनिक गुणों वाले तत्वों को एक साथ लाएं। क्षैतिज रेखाएं के अनुरूप होती हैं 7 अवधि और तत्वों को समान इलेक्ट्रॉनिक परतों के साथ प्रस्तुत करता है।
हाइड्रोजन एक ऐसा तत्व है जो अपने इलेक्ट्रॉनिक वितरण के कारण समूह 1 से ऊपर है, लेकिन इसमें उनके साथ कोई विशेषता नहीं है।
इसकी जाँच पड़ताल करो आवर्त सारणी पूर्ण और अद्यतन।
धातुओं
आवर्त सारणी में अधिकांश रासायनिक तत्वों को धातुओं के रूप में वर्गीकृत किया गया है। धातुओं की मुख्य विशेषताएं हैं:
- उनके पास एक विशेषता चमक है;
- वे घने, निंदनीय और नमनीय हैं;
- वे बिजली और गर्मी के अच्छे संवाहक हैं;
- वे पारा के अपवाद के साथ, ठोस अवस्था में परिवेशी परिस्थितियों में मौजूद हैं।
आवर्त सारणी के धात्विक तत्व हैं:
क्षारीय धातु (समूह 1): लिथियम, सोडियम, पोटेशियम, रूबिडियम, सीज़ियम और फ्रांसियम।
क्षारीय पृथ्वी धातु (समूह 2): बेरिलियम, मैग्नीशियम, कैल्शियम, स्ट्रोंटियम, बेरियम और रेडियम।
प्रतिनिधि मामले, समूह 1 और 2 के तत्वों के अलावा, हैं: एल्यूमीनियम, गैलियम, इंडियम, थैलियम, नियॉन, टिन, सीसा, फ्लोरोवियम, बिस्मथ, मस्कोवियम और लिवरमोरियम।
बाहरी संक्रमण धातु आवर्त सारणी के मध्य भाग पर कब्जा करने वाले तत्व हैं:
- समूह 3: स्कैंडियम और यट्रियम।
- समूह 4: टाइटेनियम, ज़िरकोनियम, हेफ़नियम और रदरफोर्डियम।
- समूह 5: वैनेडियम, नाइओबियम, टैंटलम और ड्यूबनियम।
- समूह 6: क्रोमियम, मोलिब्डेनम, टंगस्टन और सीबोर्गियम।
- समूह 7: मैंगनीज, टेक्नेटियम, रेनियम और बोहरियम।
- समूह 8: लोहा, रूथेनियम, ऑस्मियम और हैसियम।
- समूह 9: कोबाल्ट, रोडियम, इरिडियम और मीटनेरियम।
- समूह 10: निकल, पैलेडियम, प्लैटिनम, डार्मस्टेडियम।
- समूह 11: तांबा, चांदी, सोना और रेंटजेन।
- समूह 12: जस्ता, कैडमियम, पारा और कॉपरनिकियम।
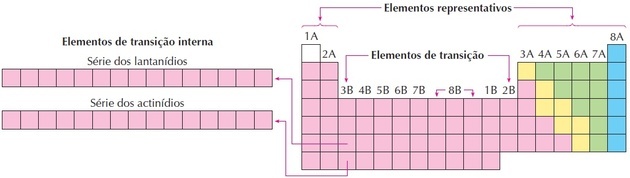
आंतरिक संक्रमण धातु वे तत्व हैं जो समूह 3 का हिस्सा हैं और लैंथेनाइड और एक्टिनाइड श्रृंखला के तत्वों के अनुरूप हैं।
लैंथेनाइड श्रृंखला में लैंथेनम, सेरियम, प्रेजोडायमियम, नियोडिमियम, प्रोमेथियम, समैरियम, यूरोपियम, गैडोलिनियम, टेरबियम, डिस्प्रोसियम, होल्मियम, एर्बियम, थ्यूलियम, येटरबियम और ल्यूटेटियम शामिल हैं।
एक्टिनाइड श्रृंखला में एक्टिनियम, थोरियम, प्रोटैक्टीनियम, यूरेनियम, नेपच्यूनियम, प्लूटोनियम, एमरिकियम, क्यूरियम, बर्केलियम, कैलिफ़ोर्नियम, आइंस्टीनियम, फ़र्मियम, मेंडेलीवियम, नोबेलियम और लॉरेंस तत्व शामिल हैं।
के बारे में और पढ़ें क्षारीय धातु.
अधातु
गैर-धातुएं आवर्त सारणी के दाहिने हिस्से में स्थित हैं और धातुओं के विपरीत विशेषताएं हैं, उदाहरण के लिए:
- उनके पास चमकदार उपस्थिति नहीं है;
- वे बिजली और गर्मी के अच्छे संवाहक नहीं हैं, इसलिए उन्हें इन्सुलेटर के रूप में उपयोग किया जाता है;
- इनके क्वथनांक और गलनांक कम होते हैं, इतने सारे प्रकृति में तरल अवस्था में पाए जाते हैं।
आप अधात्विक तत्व आवर्त सारणी के हैं: हाइड्रोजन, नाइट्रोजन, ऑक्सीजन, कार्बन, फास्फोरस, सेलेनियम, सल्फर, हैलोजन और उत्कृष्ट गैसें।
आप हैलोजन वे तत्व हैं जो समूह 17 से संबंधित हैं: फ्लोरीन, क्लोरीन, ब्रोमीन, आयोडीन, एस्टैटिन, टेनेसीन और महान गैस परिवार।
आप उत्कृष्ट गैस वे तत्व हैं जो समूह 18 से संबंधित हैं: हीलियम, नियॉन, आर्गन, क्रिप्टन, क्सीनन, रेडॉन, ओगनेसन।
के बारे में और जानें उत्कृष्ट गैस और यह हैलोजन.
अर्धधातु
सेमीमेटल या मेटलॉयड हैं: बोरॉन, सिलिकॉन, जर्मेनियम, आर्सेनिक, सुरमा, टेल्यूरियम और पोलोनियम। इन तत्वों में ऐसी विशेषताएं हैं जो धातुओं और अधातुओं के बीच मध्यवर्ती हैं।
के बारे में भी पढ़ें आवर्त सारणी परिवार.
प्रतिनिधि और संक्रमण तत्व
तत्वों को वर्गीकृत करने का एक और तरीका है कि उन्हें प्रतिनिधि और संक्रमण तत्वों में विभाजित किया जाए: परमाणु का इलेक्ट्रॉनिक वितरण.

आप प्रतिनिधि तत्व वे हैं जिनके पास इलेक्ट्रॉनिक कॉन्फ़िगरेशन सबसे ऊर्जावान सबलेवल के साथ समाप्त होता है एस (समूह 1 और 2) या के लिये (समूह 13, 14, 15, 16, 17 और 18)।

आप संक्रमण तत्व में विभाजित हैं बाहरी संक्रमण, उन तत्वों के साथ जिनमें सबलेवल में सबसे ऊर्जावान इलेक्ट्रॉन होता है डी और वो आंतरिक संक्रमण, जहां सबसे ऊर्जावान इलेक्ट्रॉन एक सबलेवल में होता है एफ.

सामग्री के साथ अधिक ज्ञान प्राप्त करें:
- आवधिक गुण
- आवर्त सारणी अभ्यास
- आवर्त सारणी के संगठन पर अभ्यास