संवयविता यह एक ऐसी घटना है जो तब देखी जाती है जब एक ही प्रकार के परमाणुओं की समान मात्रा से विभिन्न यौगिक बनते हैं।
इसलिए, हम एक ही आणविक सूत्र और विभिन्न संरचनात्मक सूत्रों या स्थानिक व्यवस्था वाले रासायनिक पदार्थ पा सकते हैं।
यह घटना कार्बनिक रसायन विज्ञान में व्यापक रूप से देखी गई है, जो कार्बन यौगिकों का अध्ययन करती है। चूंकि इस तत्व का प्रत्येक परमाणु 4 रासायनिक बंधन बना सकता है, इसलिए विभिन्न संयोजनों का निरीक्षण करना संभव है।
जैसे-जैसे परमाणुओं की व्यवस्था में परिवर्तन से नए पदार्थ बनते हैं, उनके भौतिक और रासायनिक गुण भिन्न-भिन्न होते हैं।
जब हम कहते हैं कि कौन से यौगिक हैं आइसोमरों इसका मतलब है कि उनके समान भाग हैं, क्योंकि यह शब्द ग्रीक मूल के दो शब्दों का संयोजन है: isos, का अर्थ है "वास्तव में", और मात्र, जो "भागों" है।
समरूपता के दो प्रमुख समूह समतल और अंतरिक्ष (स्टीरियोइसोमेरिज्म) हैं।
समतल समावयवता इसे यौगिकों के सपाट संरचनात्मक सूत्र द्वारा देखा जा सकता है और इसमें पाँच वर्ग हैं: स्थिति, कार्य, श्रृंखला, क्षतिपूर्ति और तनातनी।
अंतरिक्ष समरूपता यह यौगिकों के उन्मुखीकरण द्वारा देखा जाता है और इसे ज्यामितीय (सीआईएस-ट्रांस) और ऑप्टिकल में विभाजित किया जाता है।
आइसोमेरिज्म की अवधारणा 1830 में स्वीडिश वैज्ञानिक जैकब बर्जेलियस द्वारा पेश की गई थी।
आइसोमर्स के उदाहरण
श्रृंखला समरूपता यह तब होता है जब परमाणुओं का एक ही सेट एक ही कार्यात्मक समूह की संरचनाओं से जुड़ता है, लेकिन विभिन्न श्रृंखलाओं के साथ।
उदाहरण: आणविक सूत्र C4एच10 हाइड्रोकार्बन सीधे या शाखित हो सकते हैं।

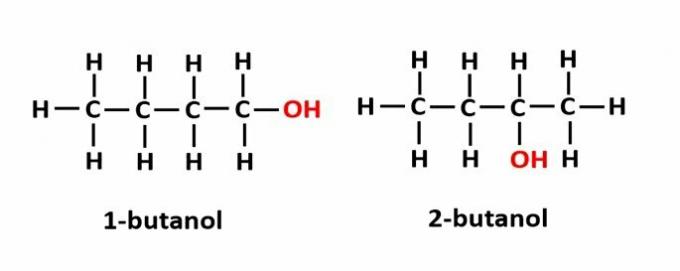
स्थिति समरूपता तब होता है जब यौगिक समान कार्यात्मक समूहों द्वारा बनते हैं, लेकिन वे श्रृंखला में विभिन्न पदों पर होते हैं।
उदाहरण: आणविक सूत्र C4एच9OH दो प्रकार के अल्कोहल से मेल खाता है।
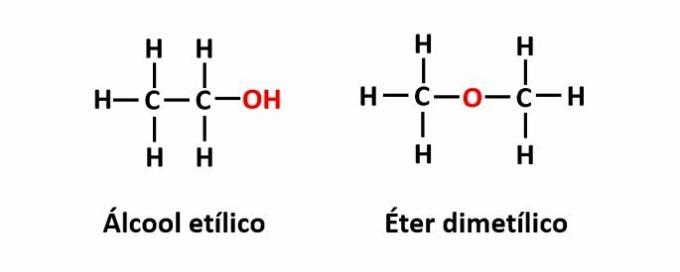
कार्य समावयवता तब होता है जब एक ही आणविक सूत्र विभिन्न कार्यात्मक समूहों वाले दो यौगिकों से मेल खाता है।
उदाहरण: आणविक सूत्र C2एच6O दो आइसोमर्स से मेल खाता है जिनमें अल्कोहल (-OH) और ईथर (-O-) कार्य होते हैं।
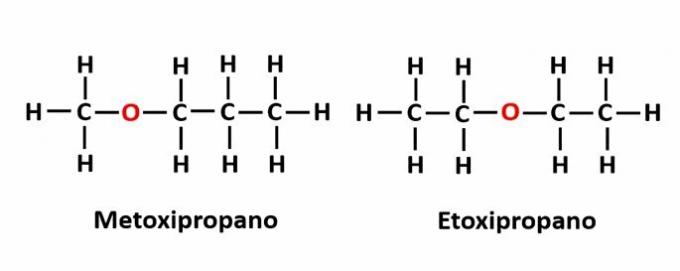
मुआवजा समरूपता यह तब होता है जब श्रृंखला में एक विषम परमाणु होता है और यह विभिन्न पदों पर काबिज होता है। यह स्थिति समरूपता का एक विशेष मामला है।
उदाहरण: आणविक सूत्र C4एच10श्रृंखला में ऑक्सीजन परमाणु की उपस्थिति को इंगित करता है, लेकिन इसकी स्थिति बदल सकती है और विभिन्न यौगिकों का निर्माण कर सकती है।
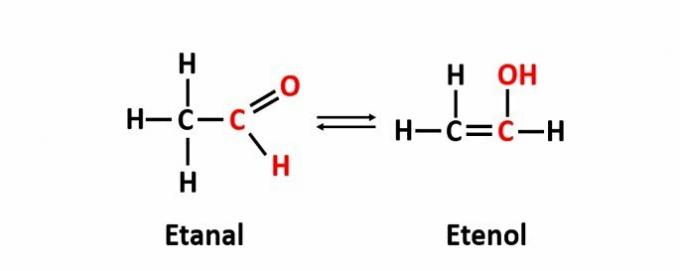
गतिशील समरूपता, जिसे टॉटोमेरी भी कहा जाता है, तब होता है जब विभिन्न कार्यों वाले दो यौगिक गतिशील संतुलन में एक ही समाधान में होते हैं। यह फ़ंक्शन आइसोमेरिज़्म का एक विशेष मामला है।
उदाहरण: आणविक सूत्र C2एच4ओ एल्डिहाइड और एनोल कार्यों के साथ यौगिकों से मेल खाता है।
के बारे में अधिक जानने समतल समावयवता.
ज्यामितीय समरूपता, जिसे आइसोमरी भी कहा जाता है सिस-ट्रांस, तब होता है जब एक दोहरे बंधन या चक्रीय संरचना की उपस्थिति के कारण समतल के एक ही तरफ समान लिगैंड होते हैं (सीआईएस) या विपरीत दिशा में (ट्रांस).
उदाहरण: आणविक सूत्र C. के यौगिकों में क्लोरीन परमाणु2एच2क्लोरीन2 उनके पास दो स्थानिक संरचनाएं हो सकती हैं।
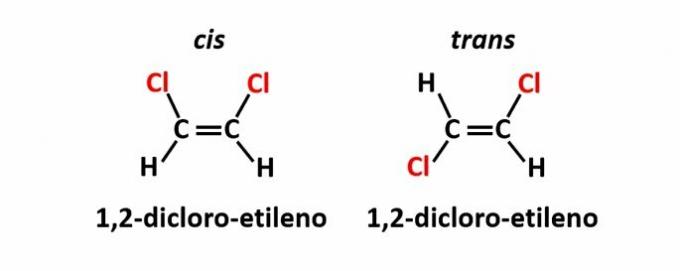
ऑप्टिकल आइसोमेरिज्म तब होता है, जब संरचना पर उत्सर्जित ध्रुवीकृत प्रकाश को विक्षेपित करते समय, यौगिक बीम को विक्षेपित करने का प्रबंधन करते हैं बाईं ओर चमकदार, यदि यह एक लीवरोटेटरी (एल) आइसोमर है, या दाईं ओर, जब यह एक डेक्सट्रोटेटरी आइसोमर है (डी)।
उदाहरण: इस प्रकार का समावयवता लैक्टिक अम्ल के साथ होता है। नीचे ध्यान दें कि आइसोमर्स की वर्णक्रमीय छवियां ओवरलैप नहीं होती हैं, इसलिए उन्हें एनैन्टीओमर कहा जाता है।
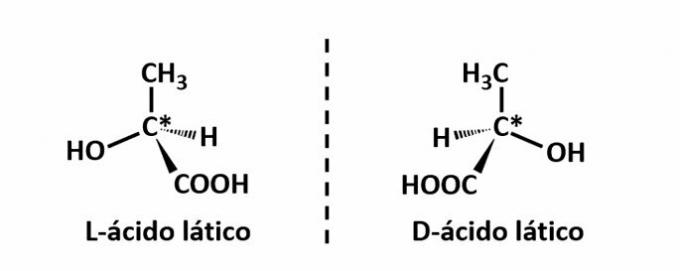
प्रतीक C* इस संरचना में एक चिरल कार्बन की उपस्थिति को इंगित करता है, अर्थात एक कार्बन परमाणु जिसमें 4 अलग-अलग लिंकर्स होते हैं।
सामग्री के साथ समरूपता के बारे में अधिक जानें:
- समरूपता के प्रकार
- अंतरिक्ष समावयवी
- ज्यामितीय समावयवी
- ऑप्टिकल आइसोमर
- समतल समावयवता पर व्यायाम

