नाइट्रेट अकार्बनिक यौगिक होते हैं जिनमें आयन NO. होता है3-.
नाइट्रोजन परिवार 15 है, संयोजकता कोश में 5 इलेक्ट्रॉन होते हैं और तीन सहसंयोजक बंध बनाने की आवश्यकता होती है (इलेक्ट्रॉनों को साझा करने के साथ) वैलेंस शेल में आठ इलेक्ट्रॉनों का होना और इस प्रकार होना स्थिर। हालाँकि, प्रत्येक ऑक्सीजन के अंतिम कोश में 6 इलेक्ट्रॉन होते हैं और इसलिए इसके प्रत्येक परमाणु को स्थिर रहने के लिए दो बंध बनाने की आवश्यकता होती है।
तो, नाइट्रेट आयन में, नाइट्रोजन केंद्रीय तत्व है, जो एक ऑक्सीजन के साथ दोहरा बंधन बनाता है, जो स्थिर है, अन्य दो ऑक्सीजनों में से एक के साथ एक एकल बंधन, और दूसरे के साथ एक सहसंयोजक बंधन मूल। इसका मतलब यह है कि ऑक्सीजन में से एक स्थिर नहीं है, 1 और इलेक्ट्रॉन प्राप्त करने की आवश्यकता है, कुल चार्ज -1 के बराबर है। डाइवेटिव नाइट्रोजन के साथ वह जितना कर सकता है उससे अधिक एक बंधन बनाता है, अपने इलेक्ट्रॉनों में से एक को दान करके, +1 के बराबर चार्ज प्राप्त करता है। इस आयन की संरचना के नीचे देखें:
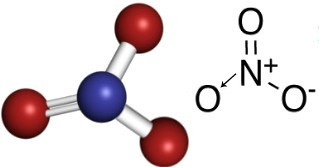
यह आयन एक इलेक्ट्रॉन प्राप्त कर सकता है और एक विद्युत रूप से तटस्थ यौगिक, एक अकार्बनिक नमक बना सकता है। ये सभी यौगिक पानी में घुलनशील हैं।
नाइट्रेट्स का मुख्य उपयोग दवाओं में होता है, जैसे एनजाइना पेक्टोरिस के उपचार में वैसोडिलेटर्स (दर्द) हृदय की मांसपेशियों में रक्त के प्रवाह द्वारा कम ऑक्सीजन की आपूर्ति के कारण) और स्तंभन दोष नर। उनका उपयोग उर्वरकों और विस्फोटकों में भी किया जाता है, जैसा कि बाद में बताया जाएगा।
नाइट्रिक एसिड (HNO) उदासीनीकरण प्रतिक्रिया के माध्यम से नाइट्रेट्स का उत्पादन किया जा सकता है।3) कुछ आधार के साथ। नीचे दिया गया उदाहरण देखें, जहां मैग्नीशियम नाइट्रेट का निर्माण हुआ था:
एचएनओ3 + मिलीग्राम (ओएच)2 → मिलीग्राम (नहीं3)2+ एच2हे
इस प्रकार के यौगिक के तीन मुख्य उदाहरण हैं: सोडियम नाइट्रेट (NaNO3), पोटेशियम नाइट्रेट (KNO .)3) और अमोनियम नाइट्रेट (NH .)4पर3). इन सभी मामलों में, धनायन (Na+,क+ और एनएच4+) नाइट्रेट आयन को 1 इलेक्ट्रॉन प्रदान करते हैं। लेकिन, वास्तव में, ये विपरीत चार्ज एक दूसरे को आकर्षित करते हैं और अच्छी तरह से परिभाषित आयनिक क्लस्टर बनाते हैं, जो क्रिस्टल जाली हैं। इस प्रकार, नाइट्रेट आमतौर पर क्रिस्टलीय ठोस होते हैं, जैसा कि सोडियम नाइट्रेट के मामले में नीचे दिखाया गया है:
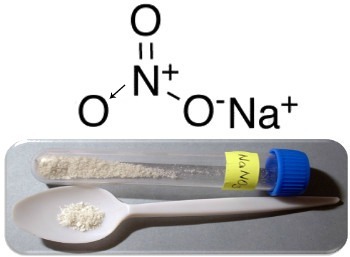
इस यौगिक का उपयोग उर्वरकों के निर्माण में किया जाता है, लेकिन इसे मुख्य रूप से के रूप में जाना जाता है चिली साल्टपीटर, क्योंकि चिली के रेगिस्तानों में इसके बड़े भंडार हैं। यह पोटेशियम नाइट्रेट में तब्दील हो जाता है, जिसका इस्तेमाल विभिन्न हथियारों और विस्फोटकों में इस्तेमाल होने वाले काले पाउडर को बनाने में किया जाता है।

सोडियम नाइट्रेट और पोटेशियम नाइट्रेट दोनों को "साल्टपेट्रे" कहा जाता है, जिसका व्यापक रूप से उपयोग किया जाता है डिब्बाबंद और स्मोक्ड मीट के रंग के संरक्षक, साथ ही कुछ खाद्य पदार्थों में की अधिक अनुभूति देने के लिए तृप्ति हालाँकि, इसके सेवन से स्वास्थ्य को गंभीर नुकसान होता है, क्योंकि इन नाइट्रेट्स को बैक्टीरिया द्वारा परिवर्तित किया जा सकता है जीव नाइट्राइट में और बाद में, नाइट्रोसामाइन में, जो कार्सिनोजेनिक होते हैं, जो मुख्य रूप से कैंसर का कारण बनते हैं पेट। नाइट्राइट रक्त में हीमोग्लोबिन को भी परिवर्तित करते हैं, जिससे वे ऑक्सीजन ले जाने में असमर्थ हो जाते हैं।
नाइट्रेट के अधिक सेवन का मुख्य कारण सब्जियों की खेती में नाइट्रोजन उर्वरकों का उपयोग है।
साल्टपीटर इसलिए भी खतरनाक है क्योंकि यह शरीर में सोडियम आयनों की सांद्रता को बढ़ाता है, जिससे उच्च रक्तचाप जैसी हृदय संबंधी समस्याएं हो सकती हैं।
हे अमोनियम नाइट्रेट इसका उपयोग उर्वरक और विस्फोटक के रूप में भी किया जाता है, और यहां तक कि 11 सितंबर, 2001 को वर्ल्ड ट्रेड सेंटर की इमारतों पर आतंकवादी हमले में ईंधन तेल के साथ भी इस्तेमाल किया गया था।

वर्ल्ड ट्रेड सेंटर पर हमले में अमोनियम नाइट्रेट* का इस्तेमाल किया गया
* छवि कॉपीराइट: डैन हॉवेल तथा शटरस्टॉक.कॉम
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक



