ब्रह्मांड में मौजूद विभिन्न पदार्थ परमाणुओं, आयनों या अणुओं से बने होते हैं। रासायनिक तत्व रासायनिक बंधों के माध्यम से संयोजित होते हैं। ये लिंक हो सकते हैं:
| सहसंयोजक बंधन | आयोनिक बंध | धातु कनेक्शन |
|---|---|---|
इलेक्ट्रॉन साझा करना |
इलेक्ट्रॉन स्थानांतरण |
धातु परमाणुओं के बीच |
रासायनिक बंधन के अपने ज्ञान का परीक्षण करने के लिए नीचे दिए गए प्रश्नों का प्रयोग करें।
प्रस्तावित अभ्यास
प्रश्न 1
विभिन्न पदार्थों के गुणों की व्याख्या करने के लिए, परमाणुओं के बीच के बंधन और संबंधित अणुओं के बीच के बंधनों को जानना आवश्यक है। परमाणुओं के बीच बंधन के संबंध में कहा जा सकता है कि...
(ए) बंधित परमाणुओं के बीच आकर्षण बल प्रबल होते हैं।
(बी) जब परमाणुओं के बीच एक बंधन बनता है, तो गठित प्रणाली अधिकतम ऊर्जा तक पहुंच जाती है।
(सी) एक अणु में आकर्षण और प्रतिकर्षण केवल प्रकृति में इलेक्ट्रोस्टैटिक नहीं होते हैं।
(डी) बाध्य परमाणुओं के बीच इलेक्ट्रोस्टैटिक आकर्षण और प्रतिकर्षण के बीच संतुलन होता है।
सही विकल्प: (डी) बाध्य परमाणुओं के बीच इलेक्ट्रोस्टैटिक आकर्षण और प्रतिकर्षण के बीच संतुलन होता है।
परमाणु विद्युत आवेशों से बनते हैं और यह कणों के बीच विद्युत बल हैं जो बंधों के निर्माण की ओर ले जाते हैं। इसलिए, सभी रासायनिक बंधन प्रकृति में इलेक्ट्रोस्टैटिक होते हैं।
परमाणुओं में बल होते हैं:
- नाभिक के बीच प्रतिकर्षण (धनात्मक आवेश);
- इलेक्ट्रॉनों के बीच प्रतिकर्षण (ऋणात्मक आवेश);
- नाभिक और इलेक्ट्रॉनों के बीच आकर्षण (धनात्मक और ऋणात्मक आवेश)।
सभी रासायनिक प्रणालियों में, परमाणु अधिक स्थिर होना चाहते हैं और यह स्थिरता एक रासायनिक बंधन में प्राप्त होती है।
स्थिरता आकर्षण और प्रतिकर्षण बलों के बीच संतुलन के कारण होती है, क्योंकि परमाणु कम ऊर्जा की स्थिति में पहुंच जाते हैं।
प्रश्न 2
कॉलम I के वाक्यों और कॉलम II में लिंकेज प्रकार का सही मिलान करें।
| मैं | द्वितीय |
|---|---|
| (ए) ना परमाणुओं के बीच | 1. एकल सहसंयोजक बंधन |
| (बी) सीएल परमाणुओं के बीच | 2. दोहरा सहसंयोजक बंधन |
| (सी) O. के परमाणुओं के बीच | 3. धातु कनेक्शन |
| (डी) एन परमाणुओं के बीच | 4. आयोनिक बंध |
| (ई) Na और Cl परमाणुओं के बीच | 5. ट्रिपल सहसंयोजक बंधन |
जवाब दे दो:
परमाणुओं |
कनेक्शन प्रकार |
प्रतिनिधित्व |
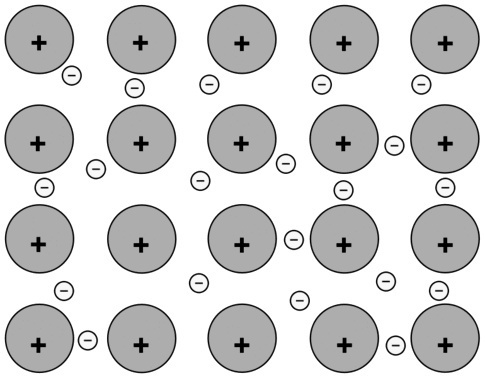
(ए) ना परमाणुओं के बीच |
धात्विक कनेक्शन। इस धातु के परमाणु धातु के बंधों के माध्यम से आपस में जुड़े रहते हैं और धनात्मक और ऋणात्मक आवेशों के बीच परस्पर क्रिया से सेट की स्थिरता बढ़ती है। |
 |
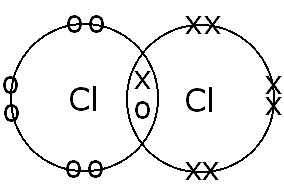
(बी) सीएल परमाणुओं के बीच |
एकल सहसंयोजक बंधन। इलेक्ट्रॉन साझाकरण और एकल बंधन गठन होता है क्योंकि बंधन इलेक्ट्रॉनों की केवल एक जोड़ी होती है। |
 |
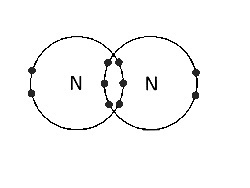
(सी) O. के परमाणुओं के बीच |
दोहरा सहसंयोजक बंधन। बंधन इलेक्ट्रॉनों के दो जोड़े हैं। |
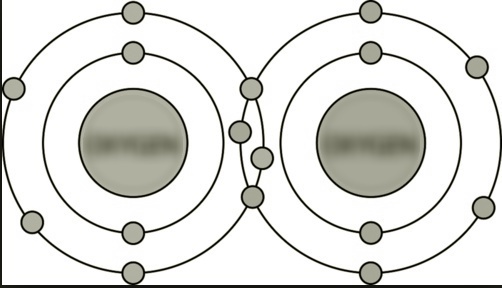 |
(डी) एन परमाणुओं के बीच |
ट्रिपल सहसंयोजक बंधन। बंधन इलेक्ट्रॉनों के तीन जोड़े हैं। |
 |
(ई) Na और Cl परमाणुओं के बीच |
आयोनिक बंध। इलेक्ट्रॉन हस्तांतरण के माध्यम से सकारात्मक आयनों (धनायनों) और नकारात्मक आयनों (आयनों) के बीच स्थापित। |
 |
प्रश्न 3
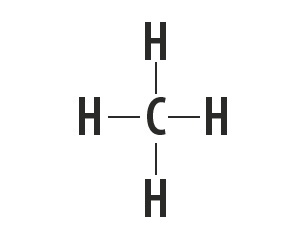
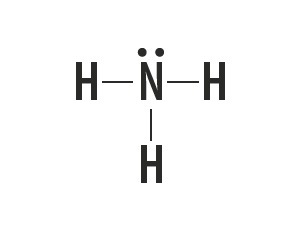
मीथेन, अमोनिया, पानी और हाइड्रोजन फ्लोराइड आणविक पदार्थ हैं जिनकी लुईस संरचनाओं को निम्न तालिका में दर्शाया गया है।
| मीथेन, सीएच4 | अमोनिया, NH3 | पानी, हो2हे | हाइड्रोजन फ्लोराइड, एचएफ |
|---|---|---|---|
 |
 |
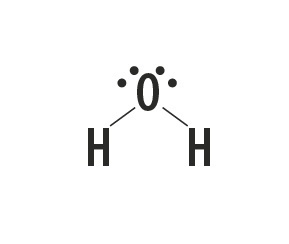 |
 |
इन अणुओं को बनाने वाले परमाणुओं के बीच स्थापित बंधन के प्रकार को दर्शाता है।
सही उत्तर: सरल सहसंयोजक बंधन।
आवर्त सारणी को देखते हुए, हम देखते हैं कि पदार्थों के तत्व धातु नहीं हैं।
इन तत्वों के बीच जिस प्रकार का बंधन बनता है, वह सहसंयोजक बंधन है, क्योंकि वे इलेक्ट्रॉनों को साझा कर रहे हैं।
कार्बन, नाइट्रोजन, ऑक्सीजन और फ्लोरीन के परमाणु वैलेंस शेल में आठ इलेक्ट्रॉन बनाते हैं क्योंकि उनके द्वारा बनाए गए बंधों की संख्या होती है। फिर वे अष्टक नियम का पालन करते हैं।
दूसरी ओर, हाइड्रोजन, इलेक्ट्रॉनों की एक जोड़ी साझा करके, सरल सहसंयोजक बंधन स्थापित करके आणविक पदार्थों के निर्माण में भाग लेता है।
यह भी देखें: रासायनिक बन्ध
प्रवेश परीक्षा प्रश्न
कॉलेज एंट्रेंस एग्जाम में केमिकल बॉन्ड्स से जुड़े सवाल बहुत ज्यादा आते हैं। नीचे देखें कि विषय से कैसे संपर्क किया जा सकता है।
प्रश्न 1
(यूईएमजी) एक निश्चित सामग्री द्वारा प्रदर्शित गुणों को इसकी बनाने वाली इकाइयों के बीच मौजूद रासायनिक बंधन के प्रकार द्वारा समझाया जा सकता है। एक प्रयोगशाला विश्लेषण में, एक रसायनज्ञ ने एक निश्चित सामग्री के लिए निम्नलिखित गुणों की पहचान की:
- उच्च पिघलने और उबलते तापमान
- जलीय घोल में अच्छी विद्युत चालकता
- ठोस अवस्था विद्युत का कुचालक
इस सामग्री द्वारा प्रदर्शित गुणों से, उस विकल्प को चिह्नित करें जो इसमें प्रमुख प्रकार के कनेक्शन को इंगित करता है:
(ए) धातु
(बी) सहसंयोजक
(सी) प्रेरित द्विध्रुवीय
(डी) आयनिक
सही विकल्प: (डी) आयनिक।
एक ठोस पदार्थ में उच्च गलनांक और क्वथनांक होता है, अर्थात इसे तरल या गैसीय अवस्था में बदलने के लिए बहुत अधिक ऊर्जा की आवश्यकता होती है।
ठोस अवस्था में, परमाणुओं के संगठन के कारण सामग्री बिजली का एक खराब संवाहक है जो एक अच्छी तरह से परिभाषित ज्यामिति बनाती है।
पानी के संपर्क में, आयन दिखाई देते हैं, धनायन और आयन बनाते हैं, जिससे विद्युत प्रवाह के मार्ग में सुविधा होती है।
जिस प्रकार के बंधन से सामग्री में ये गुण होते हैं वह आयनिक बंधन है।
प्रश्न 2
(पीयूसी-एसपी) नीचे दी गई तालिका में भौतिक गुणों का विश्लेषण करें:
| नमूना | संलयन बिंदु | क्वथनांक | 25 डिग्री सेल्सियस पर विद्युत चालकता | 1000 डिग्री सेल्सियस पर विद्युत चालकता |
|---|---|---|---|---|
| 801°C | १४१३ डिग्री सेल्सियस | इन्सुलेट | कंडक्टर | |
| ख | 43°C | १८२ डिग्री सेल्सियस | इन्सुलेट | |
| सी | १५३५ डिग्री सेल्सियस | २७६० डिग्री सेल्सियस | कंडक्टर | कंडक्टर |
| घ | १२४८ डिग्री सेल्सियस | २२५० डिग्री सेल्सियस | इन्सुलेट | इन्सुलेट |
रासायनिक बंधन मॉडल के अनुसार, ए, बी, सी और डी को क्रमशः वर्गीकृत किया जा सकता है, जैसे,
(ए) आयनिक यौगिक, धातु, आणविक पदार्थ, धातु।
(बी) धातु, आयनिक यौगिक, आयनिक यौगिक, आणविक पदार्थ।
(सी) आयनिक यौगिक, आणविक पदार्थ, धातु, धातु।
(डी) आणविक पदार्थ, आयनिक यौगिक, आयनिक यौगिक, धातु।
(ई) आयनिक यौगिक, आणविक पदार्थ, धातु, आयनिक यौगिक।
सही विकल्प: (ई) आयनिक यौगिक, आणविक पदार्थ, धातु, आयनिक यौगिक।
नमूनों की भौतिक अवस्थाओं का विश्लेषण करते हुए जब वे प्रस्तुत किए गए तापमान के अधीन होते हैं, तो हमें यह करना होता है:
| नमूना | 25°C. पर भौतिक अवस्था | 1000°C. पर भौतिक अवस्था | यौगिकों का वर्गीकरण |
| ठोस | तरल | ईओण का | |
| ख | ठोस | मोलेकुलर | |
| सी | ठोस | ठोस | धातु |
| घ | ठोस | ठोस | ईओण का |
यौगिक ए और डी दोनों ठोस अवस्था में (25 डिग्री सेल्सियस पर) इन्सुलेटर हैं, लेकिन जब नमूना ए तरल अवस्था में बदल जाता है तो यह प्रवाहकीय हो जाता है। ये आयनिक यौगिकों की विशेषताएं हैं।
जिस तरह से परमाणु खुद को व्यवस्थित करते हैं, उसके कारण ठोस अवस्था आयनिक यौगिक चालकता की अनुमति नहीं देते हैं।
समाधान में, आयनिक यौगिक आयनों में बदल जाते हैं और बिजली का संचालन करने की अनुमति देते हैं।
धातुओं की यह विशेषता है कि उनमें नमूना C जैसी अच्छी चालकता होती है।
आणविक यौगिक विद्युत रूप से तटस्थ होते हैं, अर्थात नमूना बी जैसे इन्सुलेटर।
यह भी देखें: धातु कड़ियाँ
प्रश्न 3
(फुवेस्ट) हाइड्रोजन, कार्बन, सोडियम और कैल्शियम के साथ क्रमशः क्लोरीन बनाने वाले तत्व पर विचार करें। इनमें से किस तत्व के साथ क्लोरीन सहसंयोजक यौगिक बनाता है?
जवाब दे दो:
| तत्वों | कॉल कैसे होती है | बंधन बन गया | |
| क्लोरीन | हाइड्रोजन | 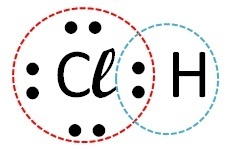 |
सहसंयोजक (इलेक्ट्रॉन साझाकरण) |
| क्लोरीन | कार्बन | 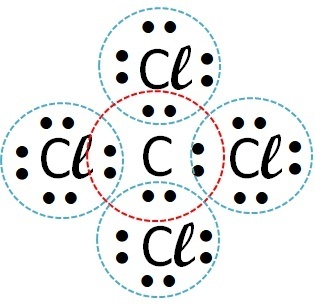 |
सहसंयोजक (इलेक्ट्रॉन साझाकरण) |
| क्लोरीन | सोडियम |  |
आयनिक (इलेक्ट्रॉन स्थानांतरण) |
| क्लोरीन | कैल्शियम | 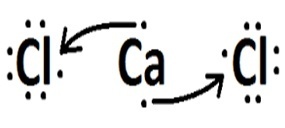 |
आयनिक (इलेक्ट्रॉन स्थानांतरण) |
सहसंयोजक यौगिक गैर-धातु परमाणुओं, गैर-धातुओं के हाइड्रोजन के साथ या दो हाइड्रोजन परमाणुओं के बीच परस्पर क्रिया में होते हैं।
तो सहसंयोजक बंधन क्लोरीन + हाइड्रोजन और क्लोरीन + कार्बन के साथ होता है।
सोडियम और कैल्शियम धातु हैं और एक आयनिक बंधन के माध्यम से क्लोरीन से बंधते हैं।
एनीम प्रश्न
विषय के प्रति एनेम का दृष्टिकोण हमने अब तक जो देखा है उससे थोड़ा भिन्न हो सकता है। देखें कि 2018 के परीक्षण में रासायनिक बांड कैसे दिखाई दिए और इस सामग्री के बारे में थोड़ा और जानें।
प्रश्न 1
(एनेम/2018) अनुसंधान से पता चलता है कि परमाणु-आयामी आंदोलनों के आधार पर नैनोडिवाइस, induced द्वारा प्रेरित प्रकाश, भविष्य की प्रौद्योगिकियों में अनुप्रयोग हो सकते हैं, घटकों की आवश्यकता के बिना माइक्रोमोटर्स की जगह ले सकते हैं यांत्रिकी एक पतली सिलिकॉन वेफर को मोड़कर प्रकाश-प्रेरित आणविक गति का एक उदाहरण देखा जा सकता है, दो तरंग दैर्ध्य में एक एज़ोबेंजीन बहुलक और एक समर्थन सामग्री के लिए बंधुआ, जैसा कि illustrate में दिखाया गया है आंकड़ा। प्रकाश के अनुप्रयोग के साथ, बहुलक श्रृंखला की प्रतिवर्ती प्रतिक्रियाएं होती हैं, जो प्रेक्षित गति को बढ़ावा देती हैं।
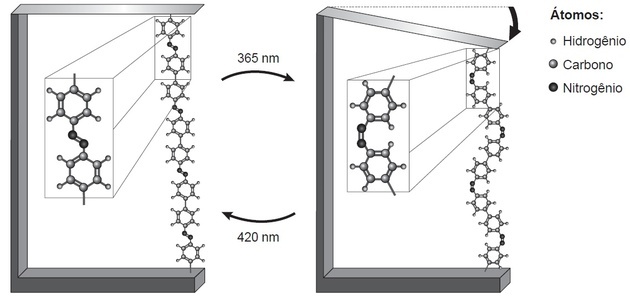
टेक, एच. तथा। अणुओं की नैनो तकनीक। स्कूल में नई रसायन विज्ञान, एन। २१, मई २००५ (अनुकूलित)।
प्रकाश के आपतन द्वारा प्रवर्तित आण्विक गति की परिघटना उत्पन्न होती है- (a)
(ए) परमाणुओं की कंपन गति, जो बंधनों को छोटा और शिथिल करती है।
(बी) एन = एन बॉन्ड का आइसोमेराइजेशन, पॉलीमर का सीआईएस फॉर्म ट्रांस की तुलना में अधिक कॉम्पैक्ट होता है।
(सी) बहुलक की मोनोमेरिक इकाइयों का टॉटोमेराइजेशन, जो एक अधिक कॉम्पैक्ट यौगिक की ओर जाता है।
(डी) एज़ो समूह के π इलेक्ट्रॉनों और सुगंधित अंगूठी के बीच अनुनाद जो डबल बॉन्ड को छोटा करता है।
(ई) एन = एन बांड की संरचना भिन्नता जिसके परिणामस्वरूप विभिन्न सतह क्षेत्रों के साथ संरचनाएं होती हैं।
सही विकल्प: (बी) एन = एन बॉन्ड का आइसोमेराइजेशन, पॉलीमर का सीआईएस फॉर्म ट्रांस की तुलना में अधिक कॉम्पैक्ट होता है।
बहुलक श्रृंखला में आंदोलन के कारण बाईं ओर एक लंबा बहुलक देखा जाता है और दाईं ओर एक छोटा होता है।
हाइलाइट किए गए बहुलक भाग के साथ, हम दो चीजों का निरीक्षण करते हैं:
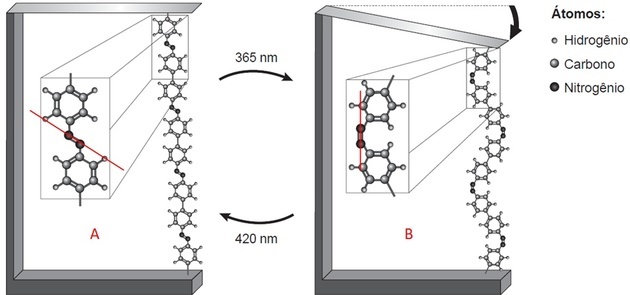
- दो संरचनाएं हैं जो दो परमाणुओं के बीच एक बंधन से जुड़ी हुई हैं (जो कि किंवदंती इंगित करती है कि नाइट्रोजन है);
- यह लिंक प्रत्येक छवि में अलग-अलग स्थिति में है।
छवि पर एक रेखा खींचते हुए, ए में हम देखते हैं कि संरचनाएं धुरी के ऊपर और नीचे हैं, यानी विपरीत पक्ष हैं। बी में, वे खींची गई रेखा के एक ही तरफ हैं।
नाइट्रोजन स्थिर होने के लिए तीन बंधन बनाता है। यदि यह एक बंधन द्वारा संरचना के लिए बाध्य है, तो यह एक सहसंयोजक दोहरे बंधन के माध्यम से अन्य नाइट्रोजन के लिए बाध्य है।
पॉलिमर संघनन और ब्लेड फ्लेक्सिंग होता है क्योंकि एन = एन बॉन्ड के आइसोमेरिज्म होने पर बाइंडर्स अलग-अलग स्थिति में होते हैं।
ट्रांस आइसोमेरिज्म ए (विपरीत पक्षों पर लिंकर्स) और बी में सीआईएस (एक ही विमान में लिंकर्स) में मनाया जाता है।
प्रश्न 2
(एनेम/2018) कुछ ठोस पदार्थ परमाणुओं से बने होते हैं जो एक-दूसरे के साथ परस्पर क्रिया करते हैं जो सहसंयोजक, आयनिक या धात्विक हो सकते हैं। आंकड़ा एक क्रिस्टलीय ठोस में अंतर-परमाणु दूरी के एक समारोह के रूप में बंधन की संभावित ऊर्जा को दर्शाता है। इस आंकड़े का विश्लेषण करते हुए, यह देखा गया है कि, शून्य केल्विन के तापमान पर, परमाणुओं के बीच बंधन की संतुलन दूरी (R)0) संभावित ऊर्जा के न्यूनतम मूल्य से मेल खाती है। उस तापमान से ऊपर, परमाणुओं को आपूर्ति की जाने वाली तापीय ऊर्जा उनकी गतिज ऊर्जा को बढ़ाती है और इसका कारण बनती है वे एक औसत संतुलन स्थिति (भरे घेरे) के चारों ओर घूमते हैं, जो प्रत्येक के लिए अलग है तापमान। कनेक्शन की दूरी क्षैतिज रेखाओं की पूरी लंबाई में भिन्न हो सकती है, जिसे T. के तापमान मान से पहचाना जाता है1 टी4 (बढ़ते तापमान)।

औसत दूरी में देखे गए विस्थापन से की घटना का पता चलता है
(ए) आयनीकरण।
(बी) फैलाव।
(सी) पृथक्करण।
(डी) सहसंयोजक बंधनों को तोड़ना।
(ई) धात्विक बंधों का निर्माण।
सही विकल्प: (बी) फैलाव।
परमाणुओं में धनात्मक और ऋणात्मक आवेश होते हैं। बांड तब बनते हैं जब वे परमाणुओं के बीच बलों (प्रतिकर्षण और आकर्षण) को संतुलित करके न्यूनतम ऊर्जा तक पहुंच जाते हैं।
इससे हम समझते हैं कि: एक रासायनिक बंधन होने के लिए परमाणुओं के बीच एक आदर्श दूरी होती है ताकि वे स्थिर रहें।
दिखाया गया ग्राफिक हमें दिखाता है कि:
- दो परमाणुओं (अंतरपरमाण्विक) के बीच की दूरी न्यूनतम ऊर्जा तक पहुंचने तक घटती जाती है।
- ऊर्जा में वृद्धि हो सकती है जब परमाणु इतने करीब हो जाते हैं कि उनके नाभिक में सकारात्मक चार्ज एक दूसरे को पीछे हटाना शुरू कर देते हैं, और परिणामस्वरूप ऊर्जा में वृद्धि होती है।
- तापमान टी. पर0 शून्य का केल्विन स्थितिज ऊर्जा का न्यूनतम मान है।
- T. के तापमान में वृद्धि होती है1 टू टू4 और आपूर्ति की गई ऊर्जा परमाणुओं को संतुलन स्थिति (भरे हुए घेरे) के चारों ओर दोलन करने का कारण बनती है।
- प्रत्येक तापमान के अनुरूप वक्र और पूर्ण वृत्त के बीच दोलन होता है।
जैसे-जैसे तापमान अणुओं के आंदोलन की डिग्री को मापता है, तापमान जितना अधिक होता है, परमाणु उतना ही अधिक दोलन करता है और उसके द्वारा घेरा गया स्थान बढ़ता है।
उच्चतम तापमान (T4) इंगित करता है कि परमाणुओं के उस समूह द्वारा अधिक स्थान घेरा जाएगा और इस प्रकार, सामग्री का विस्तार होता है।
प्रश्न 3
(एनेम/2019) क्योंकि उनके पास एक पूर्ण संयोजकता परत, उच्च आयनीकरण ऊर्जा और इलेक्ट्रॉनिक आत्मीयता है व्यावहारिक रूप से शून्य, यह लंबे समय तक माना जाता था कि महान गैसें यौगिक नहीं बनातीं रसायन। हालांकि, 1962 में, क्सीनन (5s-5p⁶ वैलेंस परत) और प्लैटिनम हेक्साफ्लोराइड के बीच प्रतिक्रिया को सफलतापूर्वक अंजाम दिया गया था और तब से, अधिक नए महान गैस यौगिकों को संश्लेषित किया गया है।
इस तरह के यौगिकों से पता चलता है कि कोई भी अष्टक नियम को अनजाने में स्वीकार नहीं कर सकता है, जिसमें यह माना जाता है कि, एक रासायनिक बंधन में, परमाणु गैस के इलेक्ट्रॉनिक विन्यास को मानकर स्थिरता प्राप्त करते हैं महान। ज्ञात यौगिकों में, सबसे स्थिर में से एक क्सीनन डिफ़्लुओराइड है, जिसमें दो हलोजन परमाणु होते हैं फ्लोरीन (2s²2p⁵ संयोजकता परत) उत्कृष्ट गैस परमाणु के साथ सहसंयोजी रूप से बंधता है, जिसमें आठ इलेक्ट्रॉन होते हैं वैलेंस
उपरोक्त क्सीनन यौगिक के लिए लुईस सूत्र लिखते समय, कुलीन गैस परमाणु में वैलेंस शेल में कितने इलेक्ट्रॉन होते हैं?
(ए) 6
(बी) 8
(सी) 10
(डी) 12
सही विकल्प: ग) 10.
फ्लोरीन एक तत्व है जो आवर्त सारणी के समूह 17 का हिस्सा है। इसलिए, इसके सबसे बाहरी इलेक्ट्रॉनिक कोश में 7 इलेक्ट्रॉन (2s2 2p5) होते हैं। स्थिरता प्राप्त करने के लिए, ऑक्टेट नियम के अनुसार, इस तत्व के परमाणु को एक इलेक्ट्रॉन की आवश्यकता होती है, इस प्रकार वैलेंस शेल में 8 इलेक्ट्रॉन होते हैं और एक महान गैस का इलेक्ट्रॉनिक विन्यास ग्रहण करते हैं।
दूसरी ओर, क्सीनन एक उत्कृष्ट गैस है, और इसलिए, इसकी अंतिम परत में पहले से ही 8 इलेक्ट्रॉन हैं (5s)2 ५पी6).
ध्यान दें कि यौगिक का नाम क्सीनन डिफ्लुओराइड है, अर्थात यौगिक दो फ्लोरीन परमाणुओं और एक क्सीनन परमाणु, XeF से बना है।2.
जैसा कि कथन कहता है, परमाणुओं के बीच रासायनिक बंधन सहसंयोजक प्रकार का होता है, अर्थात इलेक्ट्रॉनों का बंटवारा होता है।
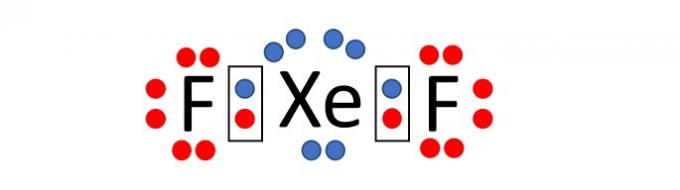
प्रत्येक परमाणु के चारों ओर इलेक्ट्रॉनों को वितरित करना (फ्लोरीन के आसपास 7 और क्सीनन के आसपास 8) हम देखते हैं कि क्सीनन परमाणु, जब दो फ्लोरीन परमाणुओं के साथ बंधता है, तो फ्लोरीन शेल में 10 इलेक्ट्रॉन होते हैं। वैलेंस
यह भी देखें:
- ओकटेट नियम
- इलेक्ट्रॉनिक वितरण पर अभ्यास
- हाइड्रोकार्बन पर व्यायाम