अकार्बनिक कार्य अकार्बनिक यौगिकों के समूह होते हैं जिनमें समान विशेषताएं होती हैं।
रासायनिक यौगिकों के संबंध में एक मौलिक वर्गीकरण है: कार्बनिक यौगिक वे होते हैं जिनमें कार्बन परमाणु होते हैं, जबकि अकार्बनिक यौगिक वे अन्य रासायनिक तत्वों द्वारा बनते हैं।
CO, CO. जैसे अपवाद हैं2 और पर2सीओ3जिसमें संरचनात्मक सूत्र में कार्बन होने के बावजूद अकार्बनिक पदार्थों के गुण होते हैं।
चार मुख्य अकार्बनिक कार्य हैं: अम्ल, क्षार, लवण और ऑक्साइड.
इन 4 मुख्य कार्यों को एक रसायनज्ञ अरहेनियस द्वारा परिभाषित किया गया था, जिन्होंने एसिड, बेस और लवण में आयनों की पहचान की थी।
एसिड
एसिड वे सहसंयोजक यौगिक हैं, अर्थात वे अपने बंधों में इलेक्ट्रॉनों को साझा करते हैं। उनके पास पानी में आयनित करने और चार्ज करने की क्षमता है, एच. जारी करते हैं+ एकमात्र कटियन के रूप में।
अम्लों का वर्गीकरण
एसिड को जलीय घोल में छोड़े जाने वाले हाइड्रोजन की मात्रा के अनुसार वर्गीकृत किया जा सकता है और हाइड्रोनियम आयन बनाने के लिए पानी के साथ प्रतिक्रिया करके आयनित किया जा सकता है।
| आयनित हाइड्रोजनों की संख्या |
|---|
|
मोनोएसिड: उनके पास केवल एक आयनीकरण योग्य हाइड्रोजन है। उदाहरण: एचएनओ3, एचसीएल और एचसीएन |
|
डाइएसिड्स: दो आयनीकृत हाइड्रोजन होते हैं। उदाहरण: हो2केवल4, हो2एस और एच2एमएनओ4 |
|
ट्राइएसिड्स: तीन आयनीकरण योग्य हाइड्रोजन होते हैं। उदाहरण: हो3धूल4 और वह3बो3 |
|
टेट्रासिड्स: चार आयनीकरण योग्य हाइड्रोजन होते हैं। उदाहरण: हो4पी7हे7 |
अम्ल की प्रबलता को आयनन की मात्रा से मापा जाता है। का मान जितना अधिक होगा अम्ल अधिक प्रबल होता है क्योंकि:
| आयनीकरण की डिग्री |
|---|
|
मजबूत: 50% से अधिक आयनीकरण की डिग्री है। |
|
उदारवादी: 5% और 50% के बीच आयनीकरण की डिग्री है। |
|
कमज़ोर: 5% से कम आयनीकरण की डिग्री है। |
एसिड में उनकी संरचना में तत्व ऑक्सीजन हो सकता है या नहीं भी हो सकता है, इस प्रकार:
| ऑक्सीजन की उपस्थिति |
|---|
|
हिड्रासिड्स: ऑक्सीजन परमाणु नहीं होते हैं। उदाहरण: एचसीएल, एचबीआर और एचसीएन। |
|
ऑक्सीएसिड्स: अम्ल संरचना में ऑक्सीजन तत्व मौजूद होता है। उदाहरण: एचसीएलओ, एच2सीओ3 और एचएनओ3. |
एसिड नामकरण
अम्ल के सामान्य सूत्र को इस प्रकार वर्णित किया जा सकता है: एचएक्सद, जहाँ A उस ऋणायन का प्रतिनिधित्व करता है जो अम्ल बनाता है और उत्पन्न नामकरण हो सकता है:
| आयनों की समाप्ति | एसिड टर्मिनेशन |
|---|---|
|
लोकाचार उदाहरण: क्लोराइड (Cl .)-) |
हाइड्रिक उदाहरण: हाइड्रोक्लोरिक एसिड (HCl) |
|
कार्य उदाहरण: क्लोरेट |
आईसीएच उदाहरण: क्लोरिक अम्ल (HClO .)3) |
|
बहुत उदाहरण: नाइट्राइट |
हड्डी उदाहरण: नाइट्रस अम्ल (HNO .)2) |
एसिड के लक्षण
अम्लों की मुख्य विशेषताएं हैं:
- इनका स्वाद खट्टा होता है।
- वे विद्युत प्रवाह ले जाते हैं, क्योंकि वे इलेक्ट्रोलाइटिक समाधान हैं।
- जब वे मैग्नीशियम और जस्ता जैसी धातुओं के साथ प्रतिक्रिया करते हैं तो वे हाइड्रोजन गैस बनाते हैं।
- कैल्शियम कार्बोनेट के साथ प्रतिक्रिया करते समय कार्बन डाइऑक्साइड का निर्माण करें।
- वे अम्ल-क्षार संकेतकों को एक विशिष्ट रंग में बदल देते हैं (नीला लिटमस पत्र लाल हो जाता है)।
मुख्य अम्ल
उदाहरण: हाइड्रोक्लोरिक एसिड (HCl), सल्फ्यूरिक एसिड (H .)2केवल4), एसिटिक अम्ल (CH .)3COOH), कार्बोनिक एसिड (H .)2सीओ3) और नाइट्रिक एसिड (HNO .)3).
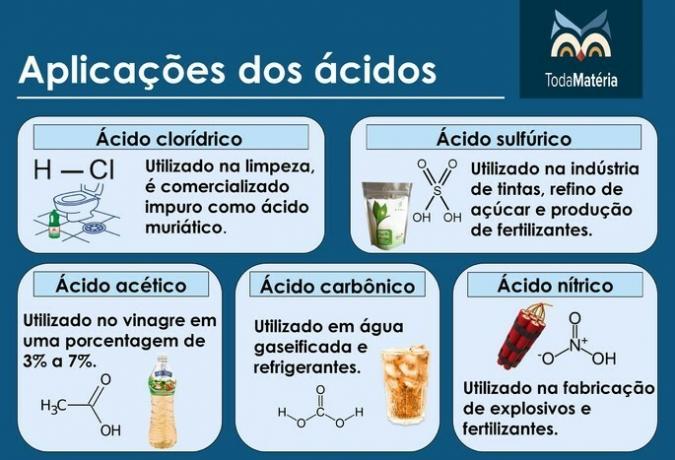
हालांकि एसिटिक एसिड कार्बनिक रसायन से एक एसिड है, इसके महत्व के कारण इसकी संरचना को जानना महत्वपूर्ण है।
अड्डों
अड्डों धनायनों द्वारा निर्मित आयनिक यौगिक हैं, ज्यादातर धातुएं, जो पानी में अलग हो जाती हैं और हाइड्रॉक्साइड आयन (OH) छोड़ती हैं।-).
आधार वर्गीकरण
घोल में छोड़े गए हाइड्रॉक्सिल की संख्या के अनुसार क्षारों को वर्गीकृत किया जा सकता है।
| हाइड्रॉक्सिल की संख्या |
|---|
|
मोनोबेस: उनके पास केवल एक हाइड्रॉक्सिल है। उदाहरण: NaOH, KOH और NH4ओह |
|
डिबासेस: दो हाइड्रॉक्सिल हैं। उदाहरण: सीए (ओएच)2, फे (ओएच)2 और एमजी (ओएच)2 |
|
जनजातियाँ: तीन हाइड्रॉक्सिल हैं। उदाहरण: अल (ओएच)3 और फे (ओएच)3 |
|
टेट्राबेस: चार हाइड्रॉक्सिल हैं। उदाहरण: एसएन (ओएच)4 और पीबी (ओएच)4 |
क्षार आम तौर पर आयनिक पदार्थ होते हैं और आधार की ताकत को पृथक्करण की डिग्री से मापा जाता है।
का मान जितना अधिक होगा आधार मजबूत है क्योंकि:
| हदबंदी डिग्री |
|---|
|
मजबूत: उनके पास पृथक्करण की डिग्री व्यावहारिक रूप से 100% है। उदाहरण:
|
|
कमज़ोर: हदबंदी की डिग्री 5% से कम है। उदाहरण: एनएच4ओएच और जेडएन (ओएच)2. |
| पानी में घुलनशीलता |
|---|
|
घुलनशील: क्षार धातु और अमोनियम क्षार। उदाहरण: सीए (ओएच)2, बा (ओएच)2 और एनएच4ओह। |
|
अल्प घुलनशील: क्षारीय पृथ्वी धातु आधार। उदाहरण: सीए (ओएच)2 और बा (ओएच)2. |
|
व्यावहारिक रूप से अघुलनशील: अन्य आधार। उदाहरण: AgOH और Al(OH)3. |
आधार नामकरण
आधार के सामान्य सूत्र को इस प्रकार वर्णित किया जा सकता है , जहाँ B उस धनात्मक मूलक का प्रतिनिधित्व करता है जो आधार बनाता है और y वह आवेश है जो हाइड्रॉक्सिल की संख्या निर्धारित करता है।
नियत भार वाले आधारों का नामकरण निम्न द्वारा दिया गया है:
| निश्चित भार के साथ आधार | ||
|---|---|---|
क्षारीय धातु |
लिथियम हाइड्रॉक्साइड |
LiOH |
| क्षारीय पृथ्वी धातु | मैग्नेशियम हायड्रॉक्साइड |
मिलीग्राम (ओएच)2 |
चांदी |
सिल्वर हाइड्रॉक्साइड |
अगोह |
| जस्ता | जिंक हाइड्रोक्साइड | जेडएन (ओएच)2 |
| अल्युमीनियम | एल्युमिनियम हाइड्रॉक्साइड | अल (ओएच)3 |
जब आधार में एक चर भार होता है, तो नामकरण दो तरह से हो सकता है:
| चर भार के साथ आधार | |||
|---|---|---|---|
| तांबा | नितंब+ | कॉपर हाइड्रॉक्साइड I | CuOH |
| कपरस हाइड्रॉक्साइड | |||
| नितंब2+ | कॉपर हाइड्रॉक्साइड II | घन (ओएच)2 | |
| कप्रिक हाइड्रॉक्साइड | |||
| लोहा | आस्था2+ | आयरन हाइड्रॉक्साइड II | फे (ओएच)2 |
| फेरस हाइड्रॉक्साइड | |||
| आस्था3+ | आयरन हाइड्रॉक्साइड III | फे (ओएच)3 | |
| फेरिक हाइड्रॉक्साइड |
ठिकानों की विशेषताएं
- अधिकांश क्षार जल में अघुलनशील होते हैं।
- जलीय विलयन में विद्युत धारा प्रवाहित करें।
- वे फिसलन हैं।
- ये अम्ल के साथ अभिक्रिया करके लवण तथा जल को उत्पाद बनाते हैं।
- वे एसिड-बेस संकेतकों को एक विशिष्ट रंग में बदलते हैं (लाल लिटमस पेपर नीला हो जाता है)।
मुख्य आधार
उत्पादों की सफाई और रासायनिक उद्योग प्रक्रियाओं में भी आधारों का व्यापक रूप से उपयोग किया जाता है।
उदाहरण: सोडियम हाइड्रॉक्साइड (NaOH), मैग्नीशियम हाइड्रॉक्साइड (Mg (OH)2), अमोनियम हाइड्रॉक्साइड (NH .)4OH), एल्युमिनियम हाइड्रॉक्साइड (Al(OH)3) और कैल्शियम हाइड्रॉक्साइड (Ca(OH)2).

लवण
लवण आयनिक यौगिक हैं जिनमें H. के अलावा कम से कम एक धनायन होता है+ और OH. के अलावा एक आयन-.
एक उदासीनीकरण प्रतिक्रिया में एक नमक प्राप्त किया जा सकता है, जो एक एसिड और एक बेस के बीच की प्रतिक्रिया है।
सोडियम हाइड्रोक्साइड के साथ हाइड्रोक्लोरिक एसिड की प्रतिक्रिया से सोडियम क्लोराइड और पानी बनता है।
बनने वाला नमक एसिड आयन (Cl .) से बना होता है-) और आधार धनायन (Na .) द्वारा+).
लवणों का वर्गीकरण
नीचे, हमारे पास लवणों के मुख्य परिवार हैं जिन्हें पानी में घुलनशीलता और घोल के पीएच परिवर्तन के अनुसार वर्गीकृत किया जा सकता है:
| सबसे आम लवण की जल घुलनशीलता | |||
|---|---|---|---|
| घुलनशील | नाइट्रेट | अपवाद: सिल्वर एसीटेट। |
|
| क्लोरेट्स | |||
एसीटेट |
|||
| क्लोराइड | अपवाद: |
||
| समन्वय से युक्त | |||
| आयोडाइड्स | |||
| सल्फेट |
अपवाद: |
||
| अघुलनशील | सल्फाइड |
अपवाद: क्षारीय पृथ्वी और अमोनियम। |
|
| कार्बोनेट्स | अपवाद: क्षार धातुओं और अमोनियम की। |
||
| फॉस्फेट |
| पीएच | |
|---|---|
| तटस्थ लवण |
पानी में घुलने पर वे पीएच नहीं बदलते हैं। उदाहरण: NaCl। |
| अम्ल लवण |
जब वे पानी में घुल जाते हैं तो वे घोल का pH 7 से कम बना देते हैं। उदाहरण: एनएच4सीएल. |
| मूल लवण |
जब वे पानी में घुल जाते हैं तो वे घोल का pH 7 से अधिक बना देते हैं। उदाहरण: सीएच3कूना। |
नमक परिवारों के अलावा, हमने पहले देखा, अन्य प्रकार के नमक भी हैं, जैसा कि नीचे दी गई तालिका में दिखाया गया है।
| अन्य प्रकार के लवण | |
|---|---|
| हाइड्रोजन लवण | उदाहरण: NaHCO3 |
| हाइड्रोक्सी-लवण | उदाहरण: अल (ओएच)2क्लोरीन |
| दोहरा लवण | उदाहरण: KNaSO4 |
| हाइड्रेटेड लवण | उदाहरण: CuSO4. पांच घंटे2हे |
| जटिल लवण | उदाहरण: [घन (NH .)3)4]केवल4 |
लवणों का नामकरण
सामान्य तौर पर, नमक का नामकरण निम्नलिखित क्रम में होता है:
| आयनों का नाम | धनायन का नाम | नमक का नाम |
|---|---|---|
|
क्लोरीन- क्लोराइड |
आस्था3+ आयरन III |
FeCl3 आयरन क्लोराइड III |
|
सल्फेट |
पर+ सोडियम |
पर2केवल4 सोडियम सल्फेट |
|
नाइट्राट |
क+ पोटैशियम |
KNO2 पोटेशियम नाइट्राइट |
|
बीआर- ब्रोमाइड |
यहाँ2+ कैल्शियम |
CaBr2 कैल्शियम ब्रोमाइड |
लवण के लक्षण
- वे आयनिक यौगिक हैं।
- वे ठोस और क्रिस्टलीय होते हैं।
- उच्च तापमान पर उबलने से पीड़ित।
- विलयन में विद्युत धारा प्रवाहित करें।
- वे नमकीन स्वाद लेते हैं।
मुख्य लवण
उदाहरण: पोटेशियम नाइट्रेट (KNO .)3), सोडियम हाइपोक्लोराइट (NaClO), सोडियम फ्लोराइड (NaF), सोडियम कार्बोनेट (Na .)2सीओ3) और कैल्शियम सल्फेट (CaSO .)4).

आक्साइड
आक्साइड वे द्विआधारी यौगिक (आयनिक या आणविक) हैं जिनमें दो तत्व होते हैं। इनके संघटन में ऑक्सीजन होता है, जो इनका सर्वाधिक विद्युत ऋणात्मक तत्व है।
ऑक्साइड के लिए सामान्य सूत्र है , जहां C धनायन है और इसका आवेश y यौगिक बनाने वाले ऑक्साइड में एक सूचकांक बन जाता है:
ऑक्साइड का वर्गीकरण
| रासायनिक बंधों के अनुसार | |
|---|---|
| ईओण का |
धातुओं के साथ ऑक्सीजन का संयोजन। उदाहरण: ZnO. |
| मोलेकुलर |
अधातु तत्वों के साथ ऑक्सीजन का संयोजन। उदाहरण: ओएस2. |
| गुणों के अनुसार | |
|---|---|
| मूल बातें |
जलीय घोल में वे pH को 7 से अधिक में बदल देते हैं। उदाहरण: मैंने पढ़ा2हे (और अन्य क्षार और क्षारीय पृथ्वी धातु)। |
| एसिड |
जलीय घोल में वे पानी के साथ प्रतिक्रिया करते हैं और एसिड बनाते हैं। उदाहरण: सीओ2, केवल3 और नहीं2. |
| तटस्थ |
कुछ ऑक्साइड जो जल के साथ अभिक्रिया नहीं करते हैं। उदाहरण: सीओ |
| पेरोक्साइड |
जलीय घोल में वे पानी या पतला एसिड के साथ प्रतिक्रिया करते हैं और हाइड्रोजन पेरोक्साइड H. बनाते हैं2हे2. उदाहरण: ना2हे2. |
| उभयचर |
वे अम्ल या क्षार की तरह व्यवहार कर सकते हैं। उदाहरण: ZnO. |
ऑक्साइड का नामकरण
सामान्य तौर पर, ऑक्साइड का नामकरण निम्नलिखित क्रम का अनुसरण करता है:
| ऑक्साइड के प्रकार के अनुसार नाम | |
|---|---|
| आयनिक ऑक्साइड |
फिक्स्ड चार्ज ऑक्साइड के उदाहरण: CaO - कैल्शियम ऑक्साइड अली2हे3 - एल्यूमीनियम ऑक्साइड |
|
परिवर्तनीय चार्ज वाले ऑक्साइड के उदाहरण: FeO - आयरन ऑक्साइड II आस्था2हे3 - आयरन ऑक्साइड III | |
| आणविक आक्साइड |
उदाहरण: सीओ - कार्बन मोनोऑक्साइड नहीं2हे5 - डाइनाइट्रोजन पेंटोक्साइड |
ऑक्साइड विशेषताएं
- वे द्विआधारी पदार्थ हैं।
- वे फ्लोरीन को छोड़कर अन्य तत्वों के साथ ऑक्सीजन के बंधन से बनते हैं।
- धातु के ऑक्साइड अम्ल के साथ अभिक्रिया करके लवण तथा जल बनाते हैं।
- अधात्विक ऑक्साइड क्षारों से अभिक्रिया करके लवण तथा जल बनाते हैं।
मुख्य आक्साइड
उदाहरण: कैल्शियम ऑक्साइड (CaO), मैंगनीज ऑक्साइड (MnO .)2), टिन ऑक्साइड (SnO .)2), आयरन ऑक्साइड III (Fe .)2हे3) और एल्युमिनियम ऑक्साइड (Al .)2सीओ3).

प्रवेश परीक्षा अभ्यास
1. (यूईएमए/2015) नहीं2और ओएस2 वे गैसें हैं जो वायुमंडलीय प्रदूषण का कारण बनती हैं, जिससे होने वाली क्षति के बीच, जिसके परिणामस्वरूप का निर्माण होता है जब ये गैसें बादलों में मौजूद पानी के कणों के साथ प्रतिक्रिया करती हैं, तो अम्लीय वर्षा होती है एचएनओ3 और वह2केवल4.
ये यौगिक, जब वायुमंडलीय वर्षा द्वारा ले जाते हैं, तो गड़बड़ी उत्पन्न करते हैं, जैसे कि पीने के पानी का संदूषण, वाहनों का क्षरण, ऐतिहासिक स्मारक आदि।
पाठ में उल्लिखित अकार्बनिक यौगिक क्रमशः कार्यों के अनुरूप हैं:
ए) लवण और ऑक्साइड
b) क्षार और लवण
ग) अम्ल और क्षार
d) क्षार और ऑक्साइड
ई) ऑक्साइड और एसिड
सही विकल्प: ई) ऑक्साइड और एसिड।
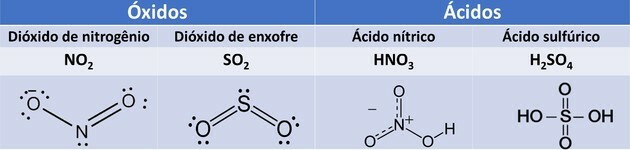
आक्साइड फ्लोरीन को छोड़कर ऑक्सीजन और अन्य तत्वों द्वारा निर्मित यौगिक हैं।
एसिड, जब वे पानी के संपर्क में आते हैं, आयनीकरण से गुजरते हैं और हाइड्रोनियम आयन का उत्पादन करते हैं। प्रश्न में एसिड के लिए, हमारे पास निम्नलिखित प्रतिक्रियाएं हैं:
एचएनओ3 यह मोनोअम्ल है क्योंकि इसमें केवल एक आयनीकरण योग्य हाइड्रोजन है। हू2केवल4 यह एक डाइएसिड है क्योंकि इसमें दो आयनीकरण योग्य हाइड्रोजन होते हैं।
प्रश्नों में मौजूद अन्य अकार्बनिक कार्य इसके अनुरूप हैं:
क्षार: हाइड्रॉक्सिल आयन (OH .)-) धातु के पिंजरों के साथ आयनिक रूप से बंधुआ।
लवण: अम्ल और क्षार के बीच उदासीनीकरण प्रतिक्रिया का उत्पाद।
के बारे में अधिक जाननेरासायनिक कार्य.
2. (UNEMAT/2012) हम अपने दैनिक जीवन में विभिन्न रासायनिक उत्पादों का उपयोग करते हैं, जैसे मैग्नीशियम दूध, सिरका, चूना पत्थर और कास्टिक सोडा।
यह कहना सही है कि उल्लिखित ये पदार्थ क्रमशः रासायनिक कार्यों से संबंधित हैं:
a) अम्ल, क्षार, लवण और क्षार
b) क्षार, लवण, अम्ल और क्षार
ग) क्षार, अम्ल, लवण और क्षार
d) अम्ल, क्षार, क्षार और लवण
ई) नमक, अम्ल, नमक और क्षार
सही विकल्प: c) क्षार, अम्ल, लवण और क्षार।
मैग्नीशियम दूध, चूना पत्थर और कास्टिक सोडा ऐसे यौगिकों के उदाहरण हैं जिनकी संरचना में अकार्बनिक कार्य होते हैं।
सिरका एक कमजोर कार्बोक्जिलिक एसिड द्वारा निर्मित एक कार्बनिक यौगिक है।
नीचे दी गई तालिका में हम उनमें से प्रत्येक की संरचना और उनकी विशेषता वाले रासायनिक कार्यों का अवलोकन कर सकते हैं।
| उत्पाद | मैग्नीशियम दूध | सिरका | चूना पत्थर | कटू सोडियम |
|---|---|---|---|---|
| रासायनिक खाद | मैग्नेशियम हायड्रॉक्साइड | सिरका अम्ल | कैल्शियम कार्बोनेट | सोडियम हाइड्रॉक्साइड |
| सूत्र | ||||
| रासायनिक कार्य | आधार | कार्बोज़ाइलिक तेजाब | नमक | आधार |
मैग्नीशियम दूध मैग्नीशियम हाइड्रॉक्साइड का एक निलंबन है जिसका उपयोग पेट के एसिड के इलाज के लिए किया जाता है, क्योंकि यह गैस्ट्रिक जूस से हाइड्रोक्लोरिक एसिड के साथ प्रतिक्रिया करता है।
सिरका मुख्य रूप से इसकी सुगंध और स्वाद के कारण भोजन तैयार करने में व्यापक रूप से उपयोग किया जाने वाला मसाला है।
चूना पत्थर एक तलछटी चट्टान है, जिसका मुख्य अयस्क कैल्साइट है, जिसमें बड़ी मात्रा में कैल्शियम कार्बोनेट होता है।
कास्टिक सोडा सोडियम हाइड्रॉक्साइड का व्यापार नाम है, जो कई औद्योगिक प्रक्रियाओं में उपयोग किया जाने वाला एक मजबूत आधार है और तेल और ग्रीस के संचय के कारण पाइपों को खोलने के लिए घरेलू उपयोग होता है।
3. (यूडीईएससी/2008) हाइड्रोक्लोरिक एसिड के संबंध में, यह कहा जा सकता है कि:
a) जब जलीय घोल में, यह विद्युत प्रवाह के पारित होने की अनुमति देता है
बी) एक डाइएसिड है
सी) एक कमजोर एसिड है
डी) आयनीकरण की निम्न डिग्री है
ई) एक आयनिक पदार्थ है
सही विकल्प: क) जलीय घोल में, यह विद्युत प्रवाह के पारित होने की अनुमति देता है।
हाइड्रोक्लोरिक एसिड एक मोनोएसिड है क्योंकि इसमें केवल एक आयनीकरण योग्य हाइड्रोजन होता है।
यह एक आणविक यौगिक है, जिसमें उच्च स्तर का आयनीकरण होता है और इसलिए यह एक मजबूत एसिड होता है, जो पानी के साथ अनुबंध में प्रवेश करते समय अपने अणु को आयनों में तोड़ता है:
जैसा कि अरहेनियस ने अपने प्रयोगों में देखा, आयनीकरण में बने धनात्मक आयन ऋणात्मक ध्रुव की ओर बढ़ते हैं, जबकि ऋणात्मक आयन धनात्मक ध्रुव की ओर बढ़ते हैं।
इस प्रकार विद्युत धारा विलयन में प्रवाहित होती है।
टिप्पणी समाधान के साथ अधिक मुद्दों के लिए, यह भी देखें: अकार्बनिक कार्यों पर अभ्यास.