परमाणु आयतन वह आयतन नहीं है जिस पर एक परमाणु कब्जा करता है, बल्कि को संदर्भित करता है किसी रासायनिक तत्व के परमाणुओं की दी गई संख्या की एक निश्चित मात्रा द्वारा कब्जा कर लिया गया आयतन।
लिखित मे रासायनिक तत्व, यह दिखाया गया था कि एक तत्व परमाणुओं के एक समूह से मेल खाता है जिनकी परमाणु संख्या समान होती है, अर्थात नाभिक में समान मात्रा में प्रोटॉन होते हैं। परमाणु आयतन की गणना के लिए स्थापित मात्रा का मान है अवोगाद्रो स्थिरांक, जो 6.02 के बराबर है। 1023 परमाणु, जो तत्व के 1 मोल से मेल खाती है।
तो हम कह सकते हैं कि परमाणु आयतन वह आयतन है जो परमाणुओं के 1 मोल (या 6.02) है। 1023 परमाणु) एक तत्व का कब्जा है।
इस मात्रा की गणना की जा सकती है यदि हम ठोस-अवस्था वाले तत्व का घनत्व और उस तत्व के परमाणुओं के 1 मोल का द्रव्यमान जानते हैं। उदाहरण के लिए, मान लें कि सोडियम (Na) का घनत्व 0.97 g/cm. के बराबर है3 और वह 6.02. 1023 सोडियम परमाणुओं का द्रव्यमान 23.0 ग्राम के बराबर होता है। तब हम घनत्व के सूत्र से सोडियम के परमाणु आयतन पर पहुँच सकते हैं। देखें के कैसे:
घनत्व = पास्ता
आयतन
परमाणु आयतन = 6.02 का द्रव्यमान। 1023 तत्व परमाणु
ठोस अवस्था तत्व घनत्व
सोडियम का परमाणु आयतन = २३.० ग्राम
0.97 ग्राम/सेमी3
सोडियम का परमाणु आयतन = 23.71 cm3
परमाणु आयतन मूल्य में न केवल परमाणुओं का आकार शामिल होता है, बल्कि उनके बीच की दूरी भी शामिल होती है। इसलिए, चूंकि इसमें रिक्त स्थान भी शामिल हैं, हम नहीं कर सकते परमाणु आयतन मान लें और परमाणुओं की संख्या (6.02.2) से विभाजित करें। 1023) प्रत्येक परमाणु का आयतन ज्ञात करना।
अब मत रोको... विज्ञापन के बाद और भी बहुत कुछ है;)
परमाणु आयतन का अध्ययन करना महत्वपूर्ण है क्योंकि यह एक आवर्त गुण है अर्थात यह तत्व के परमाणु क्रमांक के अनुसार बदलता रहता है। नीचे दी गई छवि को देखें। तत्वों का परमाणु आयतन ऊपर से नीचे की ओर बढ़ता है, जिसका अर्थ है कि जब हम आवर्त सारणी के एक ही परिवार से संबंधित तत्वों का विश्लेषण करते हैं, तो जैसे-जैसे परमाणु क्रमांक बढ़ता है, परमाणु आयतन भी बढ़ता है। ऐसा इसलिए है, क्योंकि इस अर्थ में, अवधि बढ़ जाती है, जिसका अर्थ है कि परमाणुओं की इलेक्ट्रॉनिक परतें बढ़ती हैं और फलस्वरूप, उनके द्वारा कब्जा कर लिया गया आयतन भी बढ़ जाता है। यह विकास की वही भावना है परमाणु किरण.
दूसरी ओर, क्षैतिज रूप से, हम देखते हैं कि परमाणु आयतन केंद्र से किनारों तक बढ़ता है। जब हम बायें से शुरू करते हैं और आवर्त सारणी के दायें से मध्य में जाते हैं, तो परमाणु आयतन घटता है क्योंकि आवर्त है वही, यानी एक ही रेखा के तत्वों में इलेक्ट्रॉनिक परतों की मात्रा समान होती है, लेकिन परमाणु क्रमांक होगा बढ़ रहा। इसका मतलब है कि इस दिशा में इलेक्ट्रॉनों की मात्रा बढ़ जाती है, जिसके परिणामस्वरूप अधिक बल होता है परमाणु के नाभिक के प्रति इलेक्ट्रॉनों का आकर्षण, इसकी परमाणु त्रिज्या में कमी और, परिणामस्वरूप, आयतन परमाणु। लेकिन केंद्र से दाईं ओर ऐसा होता नहीं रहता है, क्योंकि इस क्षेत्र में स्थित तत्वों के मामले में, विशेष रूप से अधातुओं के मामले में, उनके परमाणुओं के बीच की दूरी अपेक्षाकृत अधिक होती है, जो परमाणु आयतन को प्रभावित करती है, इसे बढ़ा रहे हैं।
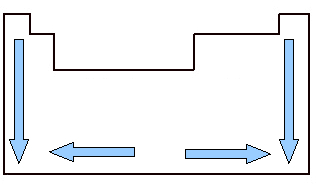
परिवारों और अवधियों में आवर्त सारणी में परमाणु आयतन भिन्नता
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक