लिखित मे "उत्प्रेरक पदार्थ कैसे काम करते हैं?”, यह दिखाया गया है कि उत्प्रेरक प्रतिक्रियाओं की गति को बढ़ाने में सक्षम हैं क्योंकि वे प्रतिक्रिया होने के लिए आवश्यक सक्रियण ऊर्जा को कम करते हैं। वे प्रतिक्रिया तंत्र को बदलकर, अभिकारकों के साथ संयोजन करके और एक मध्यवर्ती यौगिक बनाकर ऐसा करते हैं, जो बदले में उत्पाद और उत्प्रेरक बन जाता है।
ऐसा होने के तरीकों में से एक कहा जाता है सजातीय उत्प्रेरण, जो तब होता है जब उत्प्रेरक अभिकारकों के साथ एकल-चरण प्रणाली बनाता है।
इसका मतलब है कि अभिकारक, उत्पाद और उत्प्रेरक सभी को एक ही चरण में, यानी एक ही भौतिक अवस्था में होना चाहिए।
इस प्रकार के कटैलिसीस का अध्ययन विज्ञान और उद्योग के लिए महत्वपूर्ण है, क्योंकि उत्पादन के लिए कई महत्वपूर्ण प्रतिक्रियाओं को उत्प्रेरक की थोड़ी मात्रा के साथ तेज किया जा सकता है।
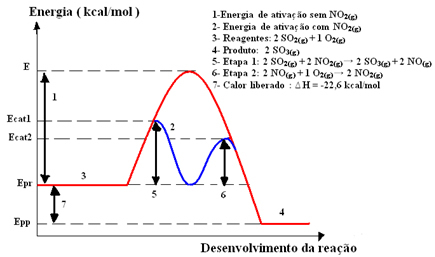
उद्योग में प्रयुक्त सजातीय उत्प्रेरण का एक उदाहरण सल्फ्यूरिक एसिड (H .) के निर्माण में एक मध्यवर्ती चरण है2केवल4(एक्यू)), जिसमें सल्फर ट्राइऑक्साइड (SO .) का निर्माण होता है3 (जी)) सल्फर डाइऑक्साइड (SO .) की दहन प्रतिक्रिया के माध्यम से2(जी)), नीचे दिखाया गया है:
2 SO2(जी) + ओ2(जी) → 2 ओएस3 (जी)
यह प्रतिक्रिया बहुत धीमी गति से आगे बढ़ती है, इसलिए एक उत्प्रेरक, नाइट्रोजन डाइऑक्साइड (NO) जोड़ा जाता है।2(जी)). यह उत्प्रेरक सल्फर डाइऑक्साइड के साथ मिलकर एक मध्यवर्ती यौगिक (सक्रिय परिसर) बनाता है, जो नाइट्रोजन मोनोऑक्साइड (NO .) है(छ)).
यह मध्यवर्ती यौगिक तब ऑक्सीजन गैस (O .) के साथ अभिक्रिया करता है2(जी)) उत्प्रेरक पुनर्जनन के लिए। नीचे देखें कि यह कैसे होता है और देखें कि वे सभी गैस चरण में कैसे हैं, एक सजातीय माध्यम बनाते हैं:
उत्प्रेरकसक्रिय परिसर
चरण 1: 2 ओएस2(जी) + 2 नहीं2(जी)→ 2 ओएस3 (जी) + 2 नहीं(छ)
चरण दो: 2 नहीं(छ)+1 ओ2(जी) → 2 नहीं2 (जी)
वैश्विक प्रतिक्रिया: 2 SO2(जी) + ओ2(जी) → 2 ओएस3 (जी)
ध्यान दें कि उत्प्रेरक केवल मध्यवर्ती चरणों में भाग लेता है, लेकिन उपभोग नहीं किया जाता है। प्रतिक्रिया के अंत में, वह पूरी तरह से ठीक हो जाता है। इस क्रियाविधि के साथ दो चरणों में की गई प्रतिक्रिया के लिए कम सक्रियण ऊर्जा की आवश्यकता होती है और इसलिए, यह अधिक तेज़ी से आगे बढ़ती है।
ग्राफिक प्रतिनिधित्व:
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/quimica/catalise-homogenea.htm

