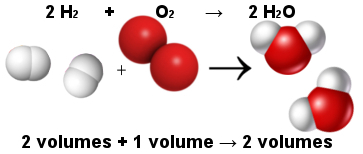
अणु दो या दो से अधिक परमाणुओं का एक स्थिर समूह है, समान या भिन्न, सहसंयोजक बंधों के माध्यम से जुड़ते हैं।
आणविक यौगिकों को ध्रुवीयता के अनुसार वर्गीकृत किया जाता है।
- एपोलर अणु: परमाणुओं के बीच वैद्युतीयऋणात्मकता में कोई अंतर नहीं है।
- ध्रुवीय अणु: धनात्मक ध्रुव और ऋणात्मक ध्रुव वाले परमाणुओं के बीच वैद्युतीयऋणात्मकता में अंतर होता है।
जब अणु एक से अधिक रासायनिक तत्वों से बनता है, तो केंद्रीय परमाणु के लिए इलेक्ट्रॉनिक बादलों और लिगेंड की संख्या ध्रुवीयता निर्धारित करती है।
अध्रुवीय अणु
अणुओं में उनके परमाणु सहसंयोजक बंधों से जुड़े होते हैं, अर्थात इलेक्ट्रॉनों को साझा किया जाता है।
वैद्युतीयऋणात्मकता यह अणु में ध्रुवों का निर्माण करते हुए, एक बंधन में इलेक्ट्रॉनों को अपनी ओर आकर्षित करने की एक परमाणु की क्षमता है।
जो परमाणु इलेक्ट्रॉनों को आकर्षित करता है वह ऋणात्मक आवेश के संचय से ऋणात्मक ध्रुव बन जाता है और दूसरा परमाणु धनात्मक ध्रुव बन जाता है।
जब एक अणु एक रासायनिक तत्व के परमाणुओं से बनता है, तो विद्युत ऋणात्मकता में कोई अंतर नहीं होता है और अणु होता है क्षमा करना.

O. जैसे सरल पदार्थों के अणु2 और नहीं2, द्वारा गठित हैं परमाणुओं एक ही तत्व का; दूसरी ओर, मिश्रित पदार्थों के अणुओं में कम से कम दो अलग-अलग तत्व होते हैं।

पर अणुओं सीओ2 और BeH2 वे ज्यामिति के कारण अध्रुवीय भी हैं। चूंकि दोनों में रैखिक ज्यामिति होती है, सिरों पर परमाणु, ऑक्सीजन और हाइड्रोजन, बंधन के इलेक्ट्रॉनों को एक-दूसरे की ओर आकर्षित करते हैं, क्योंकि वे अधिक विद्युतीय होते हैं।
बाईं ओर परमाणु का आकर्षण दाईं ओर के परमाणु के आकर्षण से संतुलित होता है। चूंकि बंध समान होते हैं, अर्थात् उनकी तीव्रता समान होती है लेकिन दिशाएँ अलग-अलग होती हैं, अणु ध्रुव नहीं बनाते हैं।
ध्रुवीय अणु
जब एक अणु विभिन्न परमाणुओं से बनता है तो विद्युत ऋणात्मकता में अंतर होता है, लेकिन यह है it अणु ज्यामिति जो निर्धारित करता है कि यह ध्रुवीय होगा या गैर-ध्रुवीय।

दोनों उदाहरणों में, हम देखते हैं कि केंद्रीय परमाणुओं, ऑक्सीजन और नाइट्रोजन में अयुग्मित इलेक्ट्रॉन जोड़े होते हैं जो इलेक्ट्रॉन बादल बनाते हैं।
चूँकि केंद्रीय परमाणु के चारों ओर जितने परमाणु जुड़े हुए हैं, उससे अधिक इलेक्ट्रॉन बादल हैं, अणु है ध्रुवीय.
एक इलेक्ट्रॉनिक बादल के निर्माण के साथ, अणु एक ऐसी संरचना ग्रहण करता है जो परमाणुओं को बेहतर ढंग से समायोजित करता है और इसलिए, पानी की ज्यामिति कोणीय और अमोनिया पिरामिडनुमा होती है।
अपने ज्ञान को समृद्ध करना चाहते हैं? नीचे दिए गए ग्रंथों को याद न करें!
- जैविक अणुओं
- अंतर आणविक बल
- आण्विक सूत्र
- मॉलिक्यूलर मास्स
टिप्पणी टेम्पलेट के साथ व्यायाम करें
1. अणुओं की ध्रुवीयता को इंगित करें:

ए) एपोलर। अणु एक ही रासायनिक तत्व, क्लोरीन से बना है। चूंकि इलेक्ट्रोनगेटिविटी में कोई अंतर नहीं है, इसलिए कोई ध्रुव नहीं बनता है।
बी) ध्रुवीय। केंद्रीय तत्व (एस) से जुड़े 4 इलेक्ट्रॉन बादल और 2 बराबर परमाणु (एच) हैं।
ग) ध्रुवीय। केंद्रीय तत्व (एस) से जुड़े 3 इलेक्ट्रॉनिक बादल और 2 बराबर परमाणु (ओ) हैं।
घ) ध्रुवीय। अणु के तत्वों में अलग-अलग इलेक्ट्रोनगेटिविटी होती है। ऋणात्मक आवेश के संचय के कारण आयोडीन में एक ऋणात्मक ध्रुव बनता है और फलस्वरूप हाइड्रोजन पक्ष एक धनात्मक ध्रुव बनाता है।
ई) ध्रुवीय। केंद्रीय तत्व (P) से जुड़े 4 इलेक्ट्रॉन बादल और 3 समान परमाणु (Cl) हैं।
च) ध्रुवीय। अणु पर आवेशों का असममित वितरण होता है, क्योंकि कार्बन में विभिन्न लिगेंड होते हैं।
जी) एपोलर। अणु द्विपरमाणुक है और एक ही रासायनिक तत्व के परमाणुओं से बना है, इसलिए वैद्युतीयऋणात्मकता में कोई अंतर नहीं है।
ज) एपोलर। इलेक्ट्रॉन बादलों की संख्या केंद्रीय परमाणु से जुड़े परमाणुओं की संख्या के बराबर होती है।
मैं) एपोलर। इलेक्ट्रॉन बादलों की संख्या केंद्रीय परमाणु से जुड़े परमाणुओं की संख्या के बराबर होती है।
2. (फुवेस्ट) एचएफ, एचसीएल, एच. के अणुओं पर विचार करें2हे, हो2, ओ2 और सीएच4.
a) इन अणुओं को दो समूहों में वर्गीकृत करें: ध्रुवीय और गैर-ध्रुवीय।
| ध्रुवीय | अध्रुवी |
|---|---|
| हाइड्रोजन फ्लोराइड (एचएफ) | आण्विक हाइड्रोजन (एच2) |
| हाइड्रोजन क्लोराइड (एचसीएल) | आण्विक ऑक्सीजन (O2) |
| पानी (एच2ओ) | मीथेन (सीएच4) |
एचएफ, एचसीएल और एच2ध्रुवीय हैं क्योंकि तीन यौगिकों में हाइड्रोजन बहुत ही विद्युतीय तत्वों के लिए बाध्य है।
एच2 यह है2 वे गैर-ध्रुवीय हैं, क्योंकि अणुओं में इलेक्ट्रोनगेटिविटी में कोई अंतर नहीं है। सीएच4 यह गैर-ध्रुवीय भी है क्योंकि इलेक्ट्रॉन बादलों की संख्या केंद्रीय परमाणु, कार्बन से जुड़े तत्वों की संख्या के बराबर होती है।
परमाणु का जिक्र करने वाली संपत्ति: वैद्युतीयऋणात्मकता.
अणु जो केवल एक रासायनिक तत्व के परमाणुओं से बने होते हैं, उन्हें गैर-ध्रुवीय के रूप में वर्गीकृत किया गया है, क्योंकि इलेक्ट्रोनगेटिविटी में कोई अंतर नहीं है।
अणु से संबंधित संपत्ति: बादलों की मात्रा और समान लिगेंड की संख्या.
विभिन्न रासायनिक तत्वों के परमाणुओं द्वारा निर्मित अणुओं को इलेक्ट्रॉनिक बादलों की संख्या और केंद्रीय परमाणु में लिगैंड की मात्रा के अनुसार ध्रुवीय या गैर-ध्रुवीय के रूप में वर्गीकृत किया गया था।
पानी ध्रुवीय है क्योंकि केंद्रीय परमाणु, ऑक्सीजन में इलेक्ट्रॉनों की एक अयुग्मित जोड़ी होती है, जिससे 3 इलेक्ट्रॉन बादल और 2 लिगैंड होते हैं। इसलिए, आवेशों का वितरण असममित है, जिससे अणु में ध्रुव बनते हैं।
मीथेन गैर-ध्रुवीय है, क्योंकि केंद्रीय परमाणु, कार्बन में लिगेंड की संख्या इलेक्ट्रॉनिक बादलों की संख्या के बराबर होती है, जिससे ज्यामिति टेट्राहेड्रल बनती है और अणु में कोई ध्रुवीयता नहीं होती है।
3. (Vunesp) नीचे दिए गए विकल्पों में से गलत कथन वाले को इंगित करें:
ए) सहसंयोजक बंधन वह है जो दो परमाणुओं के बीच इलेक्ट्रॉनों के बंटवारे के माध्यम से होता है।
बी) हाइड्रोजन और क्लोरीन परमाणुओं के बीच विद्यमान इलेक्ट्रोनगेटिविटी में अंतर के कारण सहसंयोजक यौगिक एचसीएल ध्रुवीय है।
c) क्षार धातु और हैलोजन के बीच बनने वाला यौगिक सहसंयोजक होता है।
d) सूत्र Br. का पदार्थ2 यह गैर-ध्रुवीय है।
ई) सूत्र का पदार्थ Cal2 यह आयनिक है।
गलत विकल्प: c) क्षार धातु और हैलोजन के बीच बनने वाला यौगिक सहसंयोजक होता है।
ए) सही। इस प्रकार का बंधन आमतौर पर गैर-धातुओं के बीच इलेक्ट्रॉनों के बंटवारे से मेल खाता है।
बी) सही। क्लोरीन में हाइड्रोजन की तुलना में अधिक वैद्युतीयऋणात्मकता होती है और इसलिए, इलेक्ट्रॉनों की जोड़ी को बंधन से अपनी ओर आकर्षित करती है, जिससे चार्ज असंतुलन होता है।
एचसीएल अणु ध्रुवीय है क्योंकि ऋणात्मक आवेश के संचय के कारण क्लोरीन में एक ऋणात्मक ध्रुव बनता है और, नतीजतन, हाइड्रोजन पक्ष में एक जमा धनात्मक आवेश होता है, जिससे एक ध्रुव बनता है सकारात्मक।
ग) गलत। आयनिक बंधों के माध्यम से, धातुएं इलेक्ट्रॉनों को दान करने में सक्षम होती हैं और धनायनों का निर्माण करती हैं; दूसरी ओर, हैलोजन, इलेक्ट्रॉन प्राप्त करते हैं और ऋणात्मक आवेश वाली प्रजातियाँ बनाते हैं।
डी) सही। अणु द्विपरमाणुक है और एक ही रासायनिक तत्व के परमाणुओं से बना है, इसलिए वैद्युतीयऋणात्मकता में कोई अंतर नहीं है।
ई) सही। आयनिक बंधन में, इलेक्ट्रॉनों को परमाणुओं द्वारा दान या प्राप्त किया जाता है। आयनिक यौगिक में, कैल्शियम दो इलेक्ट्रॉनों का दान करता है और धनायन Ca. बनाता है2+. आयोडीन कैल्शियम से इलेक्ट्रॉन प्राप्त करता है और एक नकारात्मक चार्ज प्रजाति बनाता है, I2-.
इस सामग्री के विषय से संबंधित मुद्दों पर इन ग्रंथों की जांच करना सुनिश्चित करें:
- आयोनिक बांड
- सहसंयोजी आबंध
- कनेक्शन की ध्रुवीयता
- सरल और यौगिक पदार्थ
- पदार्थ के सामान्य गुण