जोसेफ लूस गे-लुसाक (1778-1850) एक वैज्ञानिक थे जिन्होंने गैसों का महत्वपूर्ण अध्ययन किया। उन्होंने हाइड्रोजन और ऑक्सीजन गैसों के बीच प्रतिक्रिया से पानी का उत्पादन किया और सत्यापित किया कि वे हमेशा हाइड्रोजन के दो आयतन और ऑक्सीजन के एक आयतन के अनुपात में अभिक्रिया करता है, जिससे के दो आयतन उत्पन्न होते हैं पानी:
हाइड्रोजन + ऑक्सीजन → जल
पहला प्रयोग: 2 एल 1 एल 2 एल
दूसरा प्रयोग: 4 एल 2 एल 4 एल
तीसरा प्रयोग: 8 एल 4 एल 8 एल 8
चौथा प्रयोग: 16 एल 8 एल 160 एल
ध्यान दें कि सभी प्रयोगों में अनुपात हमेशा समान होता है: 2: 1: 2।
कई प्रयोगों और विश्लेषणों के बाद, यह महसूस करते हुए कि गैसों के बीच अन्य प्रकार की प्रतिक्रियाओं के साथ भी ऐसा ही हुआ है, यानी प्रतिक्रियाएं हमेशा एक स्थिर आयतन अनुपात का पालन किया, यह वैज्ञानिक गैसीय आयतन में प्रतिक्रियाओं के निम्नलिखित नियम पर पहुंचा, जिसे के रूप में जाना जाता है गे-लुसैक वॉल्यूमेट्रिक लॉ या मात्राओं के संयोजन का नियम:

गे-लुसाक के वॉल्यूमेट्रिक कानून का बयान
लेकिन यह कानून के खिलाफ था डाल्टन का परमाणु सिद्धांत, जिसमें कहा गया था कि सब कुछ बड़े पैमाने पर और अविभाज्य गोलाकार कणों, परमाणुओं द्वारा बनाया गया था। इस सिद्धांत के अनुसार अभिक्रिया में उत्पादों का आयतन अभिकारकों के आयतन के योग के बराबर होना चाहिए। इस प्रकार, निम्नलिखित घटित होना चाहिए:
हाइड्रोजन + ऑक्सीजन → जल
२ खंड + १ आयतन → ३ खंड
लेकिन गे-लुसाक ने दिखाया कि व्यवहार में ऐसा नहीं था, परिणाम दो मात्रा में जल वाष्प के बराबर था।
अब मत रोको... विज्ञापन के बाद और भी बहुत कुछ है;)
इस स्पष्ट विरोधाभास का उत्तर के माध्यम से आया परिकल्पना या अवोगाद्रो का नियम.

1956 में इटली में छपी स्टाम्प अमेदिओ अवोगाद्रो और उनके कानून की घोषणा को दर्शाती है*
एमेडियो अवोगाद्रो (१७७६-१८५६) ने दिखाया कि, वास्तव में, गैसें पृथक परमाणु नहीं थे, बल्कि अणु (को छोड़कर) थे उत्कृष्ट गैस). उनके कानून ने कहा:

अवोगाद्रो का नियम कथन
अवोगाद्रो ने दिखाया कि १ मोल किसी भी गैस का 6.02 होता है। 1023 अणु। इस मान के रूप में जाना जाता है अवोगाद्रो की संख्या या स्थिरांक. यह साबित हो गया था कि, तापमान और दबाव की सामान्य स्थितियों (सीएनटीपी) में, जिसमें दबाव 1 एटीएम के बराबर होता है और तापमान 273 के (0 डिग्री सेल्सियस) होता है। किसी भी गैस के 1 मोल का आयतन हमेशा 22.4 L होगा। यह मान से मेल खाता है गैसों का दाढ़ आयतन. अभ्यासों को हल करने के लिए ये संबंध बहुत महत्वपूर्ण हैं स्तुईचिओमेटरी.
यह अजीब लग सकता है, क्योंकि निम्नलिखित प्रश्न उठ सकते हैं: विभिन्न आकारों के अणुओं और परमाणुओं वाली गैसें समान मात्रा में कैसे हो सकती हैं?
ऐसा इसलिए है क्योंकि गैस के अणु इतने दूर हैं कि अणुओं का आकार नगण्य है।
इस प्रकार, अवोगाद्रो के आयतन नियम ने गे-लुसाक के आयतन नियम की व्याख्या की। नीचे ध्यान दें कि दो हाइड्रोजन अणु (दो खंड) एक ऑक्सीजन अणु (एक मात्रा) के साथ दो पानी के अणु (दो खंड) बनाने के लिए प्रतिक्रिया करते हैं। पानी और हाइड्रोजन का आयतन समान है क्योंकि उनके अणुओं की मात्रा समान है, जैसा कि अवोगाद्रो के नियम द्वारा कहा गया है।
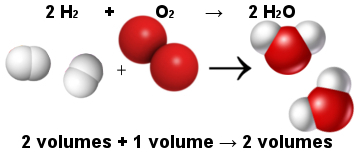
जल निर्माण प्रतिक्रिया में अणुओं के बीच अनुपात
उसी समय, अवोगाद्रो के नियम ने परमाणु सिद्धांत को खड़ा कर दिया, जैसा कि आप देखते हैं कि अभिकारकों और उत्पादों दोनों में कुल 6 परमाणु (4 हाइड्रोजन और 2 ऑक्सीजन) होते हैं।
की अवधारणा के विकास के लिए ये वॉल्यूमेट्रिक कानून बहुत महत्वपूर्ण थे अणुओं.
* छवि कॉपीराइट: बदमाश76 / शटरस्टॉक.कॉम
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
क्या आप इस पाठ को किसी स्कूल या शैक्षणिक कार्य में संदर्भित करना चाहेंगे? देखो:
FOGAÇA, जेनिफर रोचा वर्गास। "गे-लुसाक का बड़ा नियम"; ब्राजील स्कूल. में उपलब्ध: https://brasilescola.uol.com.br/quimica/lei-volumetrica-gay-lussac.htm. 28 जून, 2021 को एक्सेस किया गया।
गैसें क्या हैं, गैसों के गुण क्या हैं, आणविक यौगिक, संपीड्यता, निश्चित आयतन, गतिज ऊर्जा माध्य, गैस का निरपेक्ष तापमान, आदर्श गैस, वास्तविक गैसें, उत्तम गैस, गैस अवस्था चर, गैस का आयतन, मौसम के
रसायन विज्ञान

गे-लुसाक के नियम, प्राउस्ट का नियम, रासायनिक प्रतिक्रिया, स्थिर अनुपात, पदार्थों का द्रव्यमान, शुद्ध पदार्थ, विश्लेषण गुणात्मक और मात्रात्मक, उत्तम गैसों का नियम, स्थिर अनुपात का नियम, निश्चित अनुपात का नियम, नियम बड़ा


