थर्मोकैमिस्ट्री रसायन शास्त्र का वह हिस्सा है जो रासायनिक प्रतिक्रियाओं में शामिल गर्मी (ऊर्जा) की मात्रा का अध्ययन करता है।
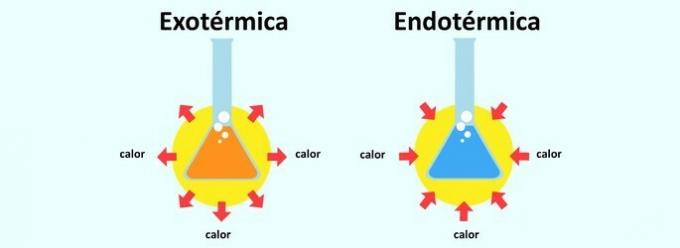
जब कोई अभिक्रिया ऊष्मा छोड़ती है, तो उसे ऊष्माक्षेपी के रूप में वर्गीकृत किया जाता है। किसी अभिक्रिया में ऊष्मा के अवशोषण के कारण यह ऊष्माशोषी हो जाती है।
थर्मोकैमिस्ट्री कुछ भौतिक घटनाओं में ऊर्जा के हस्तांतरण का भी अध्ययन करती है, जैसे कि पदार्थ की अवस्थाओं में परिवर्तन।
थर्मोकैमिस्ट्री और गर्मी
रासायनिक प्रतिक्रियाओं में, ऊर्जा को अवशोषित या छोड़ा जा सकता है। यह गर्मी हस्तांतरण उस शरीर से होता है जिसका तापमान सबसे कम होता है।
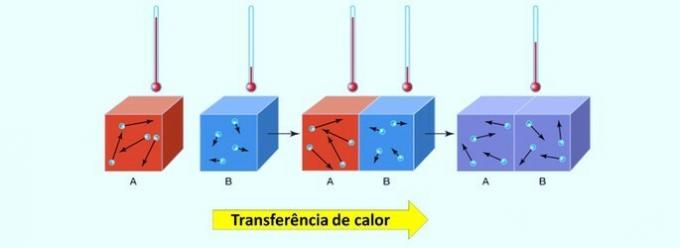
यह याद रखने योग्य है कि ऊष्मा, जिसे ऊष्मा ऊर्जा भी कहा जाता है, एक अवधारणा है जो दो निकायों के बीच तापीय ऊर्जा के आदान-प्रदान को निर्धारित करती है। हे थर्मल बैलेंस यह तब स्थापित होता है जब दो पदार्थ समान तापमान पर पहुंच जाते हैं।
एंडोथर्मिक और एक्ज़ोथिर्मिक प्रतिक्रियाएं
यह कहा जाता है ऊष्माशोषी अभिक्रिया वह अभिक्रिया जिसमें ऊष्मा अवशोषित होती है। इस तरह, एक शरीर उस वातावरण से गर्मी को अवशोषित करता है जिसमें इसे डाला जाता है। इसलिए एंडोथर्मिक प्रतिक्रिया से ठंडक का अहसास होता है।
उदाहरण: हाथ पर अल्कोहल रगड़ते समय, हाथ इस पदार्थ की गर्मी को अवशोषित करता है। लेकिन, जब शराब पीने के बाद हाथ पर फूंक मारते हैं, तो हमें थोड़ी ठंड लगती है, एक सनसनी जो एंडोथर्मिक प्रतिक्रिया का परिणाम है।
पहले से ही उष्माक्षेपी प्रतिक्रिया यह उल्टा है। यह गर्मी की रिहाई है और इस प्रकार भावना गर्म हो रही है।
उदाहरण: एक शिविर में, लोग आग के पास खड़े होते हैं ताकि आग की लपटों से निकलने वाली गर्मी उनके आसपास के लोगों को गर्म कर दे।
ऊष्मीय विनिमय भी के परिवर्तनों में होता है शारीरिक अवस्था. यह पता चला है कि, ठोस से तरल में और तरल से गैस में परिवर्तन की प्रक्रिया एंडोथर्मिक है। इसके विपरीत, गैस से द्रव में और द्रव से ठोस में परिवर्तन ऊष्माक्षेपी होता है।
तापीय धारिता
एन्थैल्पी (H) है ऊर्जा ऊर्जा अवशोषण और रिलीज प्रतिक्रियाओं में आदान-प्रदान, क्रमशः एंडोथर्मिक और एक्ज़ोथिर्मिक।
थैलेपी को मापने में सक्षम कोई उपकरण नहीं है। इस कारण से, इसकी भिन्नता (ΔH) को मापा जाता है, जो कि अभिकारक (प्रारंभिक ऊर्जा) की थैलीपी और उत्पाद की थैलीपी (अंतिम ऊर्जा) को देखते हुए किया जाता है।
थैलेपी के सबसे आवर्तक प्रकार हैं:
| गठन थैलीपी | किसी पदार्थ का 1 मोल बनाने के लिए आवश्यक अवशोषित या मुक्त ऊर्जा। |
|---|---|
| दहन थैलीपी | निर्मुक्त ऊर्जा जिसके परिणामस्वरूप 1 मोल पदार्थ जलता है। |
| लिंक थैलेपी | गैसीय अवस्था में 1 मोल रासायनिक बंधन को तोड़ने में ऊर्जा अवशोषित होती है। |
जबकि थैलेपी ऊर्जा को मापता है, एन्ट्रापी रासायनिक प्रतिक्रियाओं के विकार की डिग्री को मापता है।
हेस का कानून
जर्मेन हेनरी हेस ने स्थापित किया कि:
रासायनिक अभिक्रिया में एन्थैल्पी परिवर्तन (ΔH) अभिक्रियाओं की संख्या की परवाह किए बिना केवल अभिक्रिया की प्रारंभिक और अंतिम अवस्थाओं पर निर्भर करता है।
हेस के नियम के अनुसार, ऊर्जा की भिन्नता को निम्न सूत्र द्वारा स्थापित किया जाता है:
एच = एचएफ - होमैं
कहा पे,
- एच: एन्थैल्पी भिन्नता
- एचएफ: अंतिम थैलीपी या उत्पाद थैलेपी
- एचमैं: प्रारंभिक थैलीपी या अभिकर्मक थैलेपी
इससे, हम यह निष्कर्ष निकालते हैं कि जब हम एक एक्ज़ोथिर्मिक प्रतिक्रिया का सामना करते हैं तो थैलेपी भिन्नता नकारात्मक होती है। बदले में, जब हम एक एंडोथर्मिक प्रतिक्रिया का सामना करते हैं, तो थैलेपी भिन्नता सकारात्मक होती है।
विषय के बारे में और भी अधिक जानने के लिए इन ग्रंथों की जाँच करना सुनिश्चित करें।:
- ऊष्मप्रवैगिकी
- उष्मामिति
- समझदार गर्मी
- अव्यक्त गर्मी
टिप्पणी प्रतिक्रिया के साथ व्यायाम
1. (Udesc/2011) निम्नलिखित समीकरणों को देखते हुए:
| (द) | 2सीओ(छ) + ओ2(जी) → 2CO2(छ) | H = - 565.6 kj |
| (बी) | 2CH4हे(छ) + 3O2(जी) → 2CO2(छ) + 4H2हे(1) | H = - १४६२.६ kj |
| (सी) | ३ओ2(जी) → 2O3 (जी) | H = + 426.9 kj |
| (डी) | आस्था2हे3 (जी) + 3सी(ओं) → 2Fe(ओं) + 3CO(छ) | H = +490.8 kj |
समीकरणों के संबंध में निम्नलिखित प्रस्तावों पर विचार करें:
मैं। प्रतिक्रियाएं (ए) और (बी) एंडोथर्मिक हैं।
द्वितीय. प्रतिक्रियाएं (ए) और (बी) एक्ज़ोथिर्मिक हैं।
III. प्रतिक्रियाएं (सी) और (डी) एक्ज़ोथिर्मिक हैं।
चतुर्थ। प्रतिक्रियाएं (सी) और (डी) एंडोथर्मिक हैं।
वी सबसे बड़ी ऊर्जा रिलीज के साथ प्रतिक्रिया (बी) है।
देखा। सबसे बड़ी ऊर्जा रिलीज के साथ प्रतिक्रिया (डी) है।
सही विकल्प की जाँच करें।
a) केवल कथन II, III और V सत्य हैं।
b) केवल कथन I, III और VI सत्य हैं।
c) केवल कथन I, IV और VI सत्य हैं।
d) केवल कथन II, V और VI सत्य हैं।
e) केवल कथन II, IV और V सत्य हैं।
सही विकल्प: e) केवल कथन II, IV और V सत्य हैं।
गलती। कथन III सत्य नहीं है।
कथन III के विपरीत, प्रतिक्रियाएं (सी) और (डी) एंडोथर्मिक हैं, क्योंकि थैलेपी भिन्नता में सकारात्मक संकेत गर्मी अवशोषण को इंगित करता है।
बी) गलत। इस विकल्प में उद्धृत कोई भी कथन सही नहीं है। वे गलत हैं क्योंकि:
- प्रतिक्रियाएं (ए) और (बी) एक्ज़ोथिर्मिक हैं, क्योंकि थैलेपी परिवर्तन में नकारात्मक संकेत गर्मी की रिहाई को इंगित करता है।
- प्रतिक्रियाएं (सी) और (डी) एंडोथर्मिक हैं, क्योंकि थैलेपी परिवर्तन में सकारात्मक संकेत गर्मी अवशोषण को इंगित करता है।
- प्रतिक्रिया (डी) ऊर्जा जारी नहीं करती है क्योंकि यह एंडोथर्मिक है।
ग) गलत। इस विकल्प में दिए गए तीन कथनों में से केवल IV सही है। अन्य दो गलत हैं क्योंकि:
- प्रतिक्रियाएं (ए) और (बी) एक्ज़ोथिर्मिक हैं, क्योंकि थैलेपी परिवर्तन में नकारात्मक संकेत गर्मी की रिहाई को इंगित करता है।
- प्रतिक्रिया (डी) ऊर्जा जारी नहीं करती है, थैलेपी परिवर्तन में सकारात्मक संकेत इंगित करता है कि प्रतिक्रिया एंडोथर्मिक है।
घ) गलत। कथन VI सत्य नहीं है।
कथन VI के विपरीत, प्रतिक्रिया (D) ऊर्जा मुक्त नहीं करती है, क्योंकि यह ऊष्माशोषी है।
ए) सही। कथन सही हैं क्योंकि:
- प्रतिक्रियाएं (ए) और (बी) एक्ज़ोथिर्मिक हैं, क्योंकि ऊर्जा परिवर्तन नकारात्मक है।
- प्रतिक्रियाएं (सी) और (डी) एंडोथर्मिक हैं, क्योंकि ΔH का मान सकारात्मक है।
- ऊर्जा की सबसे बड़ी रिहाई के साथ प्रतिक्रिया (बी) है, क्योंकि उच्चारण की एक्ज़ोथिर्मिक प्रतिक्रियाओं में से, यह एक नकारात्मक संकेत के साथ उच्चतम मूल्य वाला है।
ये पाठ आपको अपना ज्ञान बढ़ाने में मदद करेंगे:
- थर्मोकैमिस्ट्री पर अभ्यास
- रासायनिक परिवर्तन
- रसायनिक प्रतिक्रिया
2. (एनेम/२०११) बीन्स पकाने का एक असामान्य विकल्प थर्मस का उपयोग है। एक पैन में बीन्स का एक भाग और पानी के तीन भाग रखें और सेट को लगभग 5 मिनट तक उबलने दें, फिर सभी सामग्री को थर्मस में स्थानांतरित करें। लगभग 8 घंटे बाद, सेम पकाया जाएगा।
बीन्स को थर्मस के अंदर पकाया जाता है क्योंकि
ए) पानी सेम के साथ प्रतिक्रिया करता है, और यह प्रतिक्रिया एक्ज़ोथिर्मिक है।
बी) बीन्स आसपास के पानी से गर्मी को अवशोषित करना जारी रखते हैं, क्योंकि यह एक एंडोथर्मिक प्रक्रिया है।
सी) माना प्रणाली व्यावहारिक रूप से अलग है, सेम को ऊर्जा हासिल करने या खोने की इजाजत नहीं है।
d) प्रतिक्रिया शुरू होने के बाद थर्मस बीन्स को पकाने के लिए पर्याप्त ऊर्जा प्रदान करता है।
ई) प्रतिक्रिया में शामिल ऊर्जा पानी को गर्म करती है, जो एक स्थिर तापमान बनाए रखती है, क्योंकि यह एक एक्ज़ोथिर्मिक प्रक्रिया है।
सही विकल्प: बी) बीन्स आसपास के पानी से गर्मी को अवशोषित करना जारी रखते हैं, क्योंकि यह एक एंडोथर्मिक प्रक्रिया है।
गलती। एक रासायनिक प्रतिक्रिया नए पदार्थों के निर्माण की विशेषता है, जो बीन्स को पकाते समय नहीं होते हैं।
बी) सही। जब पानी को गर्म किया जाता है, तो उसमें गर्मी पैदा होती है और एक थर्मस इस ऊर्जा को पर्यावरण में नष्ट नहीं होने देता है। इस प्रकार, बीन्स पानी से गर्मी को अवशोषित करते हैं और एक एंडोथर्मिक प्रक्रिया की विशेषता रखते हुए पकाते हैं।
ग) गलत। प्रणाली बाहरी वातावरण से अलग है। बोतल के अंदर, सेम और पानी का सीधा संपर्क होता है और इसलिए, थर्मल एक्सचेंज कर रहा है।
घ) गलत। थर्मस फ्लास्क में सिस्टम को इन्सुलेट करने का कार्य होता है, इसके अंदर के मिश्रण को पर्यावरण के साथ गर्मी का आदान-प्रदान करने की अनुमति नहीं देता है।
ई) गलत। तापमान स्थिर नहीं है, क्योंकि पानी सेम में गर्मी स्थानांतरित करता है, यह ऊर्जा खो देता है जब तक कि दो तापमान बराबर न हों।
नीचे दिए गए लेख देखें और इस अंक में शामिल विषयों के बारे में अधिक जानें:
- भौतिक और रासायनिक परिवर्तन
- गर्मी और तापमान
- तापीय ऊर्जा