लवण रासायनिक पदार्थ हैं जो परमाणुओं के बीच आयनिक बंधों द्वारा बनते हैं। अकार्बनिक नमक फ़ंक्शन उन आयनिक यौगिकों से मेल खाता है जिनमें H than के अलावा कम से कम एक धनायन होता है+ और OH. के अलावा एक आयन-.
नमक हमारे दैनिक जीवन में मौजूद है, जिसका व्यापक रूप से भोजन और अन्य क्षेत्रों में उपयोग किया जा रहा है। वो हैं उदाहरण लवण की:
- सोडियम क्लोराइड (NaCl): लोकप्रिय रूप से टेबल सॉल्ट के रूप में जाना जाता है
- कैल्शियम कार्बोनेट (CaCO .)3): पत्थर और चूना पत्थर में मौजूद
- कैल्शियम सल्फेट (CaSO .)4): स्कूल चाक और प्लास्टर बनाता है
- सोडियम बाइकार्बोनेट (NaHCO3): खाना पकाने, दवा और सफाई एजेंट के रूप में उपयोग किया जाता है
ये पदार्थ आमतौर पर एक न्यूट्रलाइजेशन रिएक्शन में बनते हैं, जब एक एसिड और एक बेस नमक और पानी का उत्पादन करने के लिए प्रतिक्रिया करते हैं।
एचसीएल(अम्ल) + NaOH (आधार) → NaCl(नमक) + एच2हे(पानी)
इस प्रतिक्रिया में, अभिकर्मक हाइड्रोक्लोरिक एसिड (HCl) और सोडियम हाइड्रॉक्साइड (NaOH) उत्पाद सोडियम क्लोराइड (NaCl) और पानी (H) बनाते हैं।2ओ)।
आयनिक बंधन में परमाणुओं के बीच इलेक्ट्रॉनों के हस्तांतरण के साथ होता है और इसके लिए परमाणुओं में से एक धातु और दूसरा अधातु होना चाहिए। इसके साथ, सकारात्मक रासायनिक प्रजातियां, धनायन, इलेक्ट्रॉनों को दान करके और नकारात्मक रूप से चार्ज किए गए आयनों से बनते हैं, जो उन्हें प्राप्त करते हैं।
नीचे दिए गए चित्र में देखें कि सोडियम क्लोराइड (NaCl) कैसे बनता है।
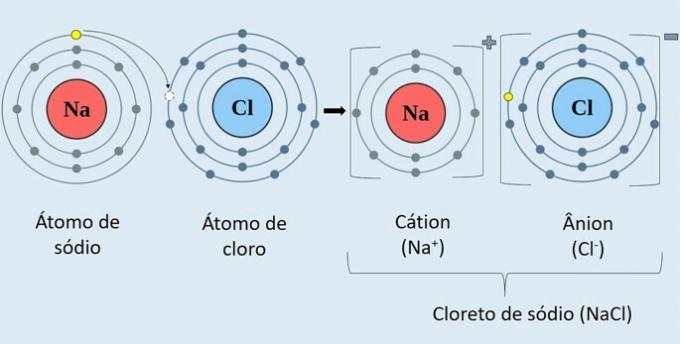
सोडियम धातु परमाणु (Na) क्लोरीन परमाणु (Cl) को एक इलेक्ट्रॉन दान करता है। इस प्रकार, Na धनायन बनता है+, जिसमें धनात्मक सोडियम आयन और Cl आयन होते हैं-, जो नकारात्मक क्लोरीन आयन से मेल खाती है।
के बारे में और जानें अम्ल और क्षार.
लवण के लक्षण
यह ध्यान रखना महत्वपूर्ण है कि, जलीय घोल में, अम्ल हमेशा H धनायन छोड़ते हैं+ और क्षार OH आयन छोड़ते हैं- (अरहेनियस अवधारणा)।
हालांकि, लवण में हमेशा एक ही धनायन या आयन नहीं होता है और इस कारण से, अच्छी तरह से परिभाषित कार्यात्मक गुण नहीं दिखाते हैं। हालाँकि, हम कह सकते हैं कि सामान्य तौर पर:
- वे आयनिक यौगिक हैं (आयनों के समूहों द्वारा बनते हैं और अणुओं से नहीं);
- कई में एक विशिष्ट नमकीन स्वाद होता है (लगभग हमेशा जहरीला);
- वे ठोस और क्रिस्टलीय हैं;
- समाधान में विद्युत प्रवाह का संचालन करें;
- वे उच्च तापमान पर पिघलने और उबलने से गुजरते हैं;
- पानी में घुलनशील (अपवाद: कुछ सल्फाइड; एजी धनायनों के साथ क्लोराइड, ब्रोमाइड और आयोडाइड+, एचजी22+ और पीबी2+, दूसरों के बीच)।
इसके बारे में भी पढ़ें रासायनिक कार्य.
लवणों का वर्गीकरण और नामकरण
नमक बनाने की प्रतिक्रिया जिस तरह से होती है, उसके अनुसार उन्हें वर्गीकृत किया जाता है तीन प्रकार:
तटस्थ या सामान्य लवण
कुल न्यूट्रलाइजेशन रिएक्शन (सभी एच रिएक्ट+ अम्ल और सभी OH- आधार का)। पानी में घुलने पर ये लवण पीएच नहीं बदलते हैं।
उदाहरण:
NaOH (क्षार) + HCl (अम्ल) → NaCl (सामान्य नमक) + H2हे
3NaOH (आधार) + एच3धूल4 (अम्ल) → Na3धूल4 (सामान्य नमक) + 3H2हे
सामान्य लवण का नाम Name: नमक का नाम एसिड आयन के नाम से आया है, जिसका समापन _हाइड्रिक या _oso या _ico क्रमशः द्वारा प्रतिस्थापित किया जाएगा: _लोकाचार ou_ito या _act और आधार कटियन।
नमक = (आयनों का नाम) + प्रत्यय ईथो/आईटीओ/एक्टमें (धनायन का नाम).
इस प्रकार:
- अम्ल क्लोरीनहाइड्रिक (HCl) + का हाइड्रॉक्साइड सोडियम (NaOH) → क्लोरीनलोकाचारसोडियम (NaCl) + जल
- अम्ल नाइट्रेटहड्डी(HNO2) + हाइड्रॉक्साइड पोटैशियम(कोह) → नाइट्रेटबहुत पोटेशियम का(KNO2) + पानी
- अम्ल आर्थोफॉस्फोरआईसीएच (2h3धूल4) + हाइड्रॉक्साइड कैल्शियम(3 सीए (ओएच)2 → ओर्थोफोस्फकार्य कैल्शियम का [यहाँ3(धूल4)2] + पानी (6H2ओ)
अम्ल लवण या हाइड्रोजन लवण
आंशिक एसिड न्यूट्रलाइजेशन रिएक्शन (जब सभी एच नहीं)+ एसिड प्रतिक्रिया करता है, इसलिए नमक की संरचना में एसिड से एक या एक से अधिक आयनीकरण योग्य हाइड्रोजेन होते हैं)।
उदाहरण:
NaOH (आधार) + एच2केवल4 (अम्ल) → NaHSO4 (अम्लीय नमक) + एच2हे
अम्ल लवण का नाम: सामान्य लवण के समान, लेकिन H. की संख्या के संकेत के साथ+ उपसर्गों द्वारा मोनो, दी, त्रि, आदि।
साल = एच संख्या उपसर्ग+ + (आयनों का नाम) + प्रत्यय ईथो/आईटीओ/एक्टमें (धनायन का नाम).
अम्ल गंधकआईसीएच (एच2केवल4) + हाइड्रॉक्साइड सोडियम(NaOH) → मोनोहाइड्रोजनगंधककार्यमें सोडियम (नाएचएसओ4) + पानी
अम्ल आर्थोफॉस्फोरआईसीएच (एच3धूल4) + हाइड्रॉक्साइड सोडियम(NaOH) → dihydrogen-ऑर्थोफॉस्फेकार्य सोडियम (नाहो2धूल4) + पानी
मूल लवण या हाइड्रॉक्सी लवण
आंशिक आधार उदासीनीकरण प्रतिक्रिया (यदि सभी हाइड्रॉक्सिल प्रतिक्रिया नहीं करते हैं, तो नमक की संरचना में एक या अधिक हाइड्रॉक्सिल होते हैं)।
उदाहरण:
सीए (ओएच)2 (बेस) + एचसीएल (एसिड) → सीए (ओएच) सीएल (बेसिक सॉल्ट) + एच2हे
मूल लवण का नाम Name: सामान्य लवण के समान, लेकिन OH संख्या को दर्शाता है- इसकी संरचना में।
सैल = OH संख्या उपसर्ग- + (आयनों का नाम) + प्रत्यय ईथो/आईटीओ/एक्टमें (धनायन का नाम).
अम्ल क्लोरीनहाइड्रिक (एचसीएल) + हाइड्रोक्साइड कैल्शियम का [सीए (ओएच)2] → मोनोहाइड्रॉक्सीक्लोरीनलोकाचार कैल्शियम का [Ca(OH)Cl] + पानी
अम्ल क्लोरीनहाइड्रिक (2HCl) + हाइड्रॉक्साइड अल्युमीनियम [अल (ओएच)3] → मोनोहाइड्रॉक्सीक्लोरीनलोकाचारमें अल्युमीनियम [अल (ओएच) सीएल2] + पानी
दोहरा या मिश्रित लवण
विभिन्न क्षारों (धनायन के लिए दोहरा नमक) या विभिन्न अम्लों के साथ di, त्रि या टेट्राबेस (आयन के लिए दोहरा नमक) के साथ एक di, ट्राई या टेट्राबेस की प्रतिक्रिया
उदाहरण:
कटियन के लिए:
एच2केवल4 (डायएसिड) + KOH (बेस) + NaOH (बेस) → KNaSO4 (डबल पोटेशियम और सोडियम सल्फेट) + 2H2हे
एच3धूल4 (ट्राईसिड) + 2KOH (बेस) + NaOH (बेस) → K2नेपो4 (मोनोसोडियम डिपोटेशियम ऑर्थोफॉस्फेट)
आयनों के लिए:
सीए (ओएच)2 (डाइबेस) + एचबीआर (एसिड) + एचसीएल (एसिड) → CaBrCl (कैल्शियम क्लोराइड-ब्रोमाइड) + 2H2हे
अल (ओएच)3 (जनजाति) + एच2केवल4(एसिड) + एचसीएल (एसिड) → अल (SO .)4)Cl (एल्यूमीनियम क्लोराइड सल्फेट) + 3H2हे
मुख्य जानिए अकार्बनिक कार्य और टिप्पणी संकल्प के साथ, विषय पर प्रवेश परीक्षा के प्रश्नों की जांच करना सुनिश्चित करें: अकार्बनिक कार्यों पर अभ्यास.