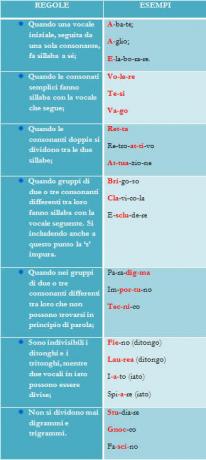
ले चेटेलियर का सिद्धांत: जब एक बल को संतुलन में एक प्रणाली पर लागू किया जाता है, तो वह उस बल के प्रभाव को कम करने के लिए खुद को समायोजित करता है।
अम्लता और क्षारकता में परिवर्तन रासायनिक संतुलन पर बाहरी शक्तियों के रूप में कार्य करते हैं। सिस्टम को तब इस बल के प्रभाव को कम करने के लिए आगे बढ़ने की जरूरत है। आइए एक ऐसे कारक का उदाहरण देखें जो एक प्रणाली, एकाग्रता के संतुलन को बदल सकता है।
2 करोड़2-4(एक्यू) + 2 एच+(यहां) CrO2-7(यहां)+ एच2हे (1)
यदि हम इस संतुलन में नींबू की कुछ बूँदें (अम्ल विलयन) मिलाते हैं, तो यह दाएँ या बायीं ओर गति करेगा और उत्पादों में से एक के निर्माण के पक्ष में होगा।
ऐसा इसलिए है क्योंकि इस क्रिया के माध्यम से हम समीकरण के किसी एक सदस्य में H+ आयनों की मात्रा बढ़ाते हैं। यदि यह बाईं ओर के अभिकारकों में होता है, तो संतुलन स्वयं को संतुलित करने के लिए दाईं ओर शिफ्ट हो जाता है।
यदि हम निकाय में मूल NaOH विलयन मिला दें तो अभिक्रिया को उलट दिया जा सकता है। OH- आयनों की उपस्थिति H+ आयनों का उपभोग करती है और संतुलन बाईं ओर शिफ्ट हो जाता है।
निष्कर्ष: जब आयन सांद्रता (CrO .)2-7
लिरिया अल्वेस द्वारा
रसायन विज्ञान में स्नातक
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/quimica/principio-le-chatelier.htm