एक समतापी परिवर्तन में, मात्रा और दबाव भिन्नता एक निश्चित गैस की, लेकिन स्थिर तापमान; इसलिए इज़ोटेर्मल नाम की उत्पत्ति (ग्रीक से: आईएसओ = बराबर; थर्मामीटरों = गर्मी)।
वैज्ञानिक बॉयल और मैरियट ने अलग-अलग समान प्रयोग किए और प्राप्त परिणाम था: जैसे-जैसे दबाव बढ़ता है, गैस की मात्रा कम हो जाती है।
ज़रा सोचिए, उदाहरण के लिए, एक सिरिंज के प्लंजर के बारे में। यदि हम इस प्लंजर पर बाहरी दबाव डालते हैं, अर्थात यदि हम दबाव बढ़ाते हैं, तो सिरिंज के अंदर व्याप्त हवा की मात्रा कम हो जाएगी, और इसके विपरीत।
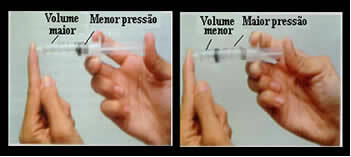
आयतन और दबाव व्युत्क्रमानुपाती होते हैं: बाएं पैनल में, दबाव छोटा होता है और हवा का आयतन बड़ा होता है। दाईं ओर, जब सिरिंज सवार पर अधिक दबाव डाला जाता है, तो आयतन कम हो जाता है.
यह एक अलग मामला नहीं है, यह कुछ ऐसा है जो गैसों के लिए सामान्य नियमितता के साथ दोहराया जाता है। इसलिए, इस तथ्य को एक कानून के रूप में कहा गया था, जिसे निम्नानुसार वर्णित किया जा सकता है:
| बाॅय्ल का नियम या बॉयल-मैरियट का नियम: स्थिर तापमान के तहत, गैस के एक निश्चित द्रव्यमान का आयतन उसके दबाव के व्युत्क्रमानुपाती होता है। |
इसका अर्थ है कि यदि हम किसी गैस का दाब दोगुना कर दें, तो उसका आयतन आधा हो जाएगा, इत्यादि। जब दो ऐसी मात्राएँ व्युत्क्रमानुपाती होती हैं, तो उनका गुणनफल एक स्थिरांक होता है; इस प्रकार, गणितीय रूप से, इस संबंध को निम्नानुसार दर्शाया जा सकता है:
अब मत रोको... विज्ञापन के बाद और भी बहुत कुछ है;)
| पी.वी = के |
जहाँ k = स्थिरांक।
इस प्रकार, यदि पहली स्थिति में हमारे पास एक निश्चित गैस का दबाव मान P1 और उसका संबंधित आयतन V1 है, तो हमें यह करना होगा:
| पी1. वी1 = के |
यदि हम इस दबाव को P2 तक बढ़ा देते हैं, तो इसका आयतन भी V2 में बदल जाएगा और हमें फिर से यह करना होगा:
| पी2 . वी2 = के |
इस प्रकार, हम इस निष्कर्ष पर पहुँचते हैं:
| पी1. वी1 = पी2. वी2 |
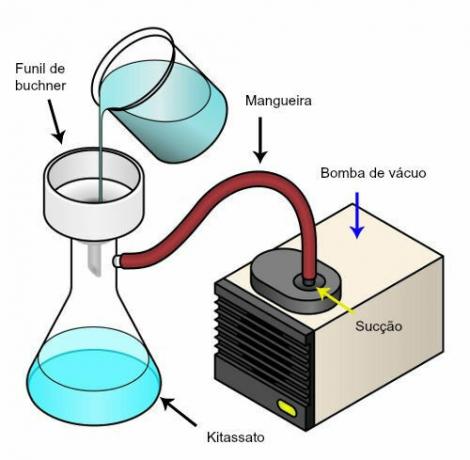
इस स्थिरता को नीचे दी गई तालिका में दिए गए उदाहरण से देखा जा सकता है, एक निश्चित द्रव्यमान वाली गैस के दबाव और आयतन:
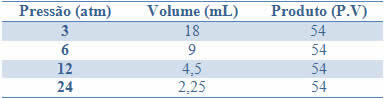
इन मानों को रेखांकन करके, हम एक वक्र का निर्माण देखेंगे।
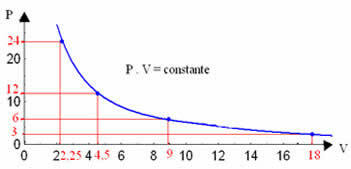
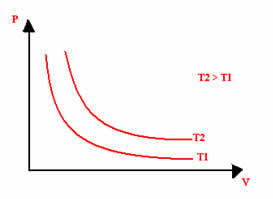
दबाव और आयतन और तापमान जिस पर प्रयोग किया गया था, के मूल्यों की परवाह किए बिना, एक इज़ोटेर्मल परिवर्तन का चित्रमय प्रतिनिधित्व हमेशा एक अतिपरवलय होगा। इस अतिपरवलय को कहते हैं इज़ोटेर्म; इसलिए, जैसा कि नीचे दिए गए ग्राफ में देखा जा सकता है, अलग-अलग तापमान अलग-अलग इज़ोटेर्म को जन्म देते हैं।
क्या आप इस पाठ को किसी स्कूल या शैक्षणिक कार्य में संदर्भित करना चाहेंगे? देखो:
FOGAÇA, जेनिफर रोचा वर्गास। "समतापी परिवर्तन या बॉयल का नियम"; ब्राजील स्कूल. में उपलब्ध: https://brasilescola.uol.com.br/quimica/transformacao-isotermica-ou-lei-boyle.htm. 27 जून, 2021 को एक्सेस किया गया।