धातुओं चमक, शक्ति, तापीय और विद्युत चालकता की विशेषता वाले तत्व हैं। वो हैं लगभग सभी औद्योगिक प्रक्रियाओं में लागू, औजारों, गहनों और सिक्कों के निर्माण में प्रयुक्त धात्विक मिश्र धातुओं में और रेडॉक्स जैसी रासायनिक प्रक्रियाओं में मौजूद होना, जिसके संचालन के लिए जिम्मेदार है ढेर और बैटरी।
आवर्त सारणी में, उन्हें निम्न में वर्गीकृत किया गया है:
अर्धधातु
संक्रमण धातुओं
क्षारीय धातु
क्षारीय पृथ्वी धातु
इस्पात उद्योग में, उन्हें विभाजित किया जाता है:
फैरस धातुओं
अलौह धातु
भारी धातुओं
यह भी पढ़ें: आवर्त सारणी के नए तत्व क्या हैं?
धातु की विशेषताएं

अधिकांश भाग के लिए, वे गर्मी और विद्युत ऊर्जा के उत्कृष्ट संवाहक हैं।
उनके पास एक चमकदार उपस्थिति है।
उच्च है घनत्व.
वे विद्युत धनात्मक तत्व हैं (वे धनायन बनाने की प्रवृत्ति रखते हैं - धनात्मक आवेश)।
के अपवाद के साथ बुध, वे उच्च गलनांक वाले तत्व हैं और कमरे के तापमान पर ठोस हैं।
उनके पास यांत्रिक शक्ति (तप) है।
वे निंदनीय हैं (बिना टूटे ढाले जा सकते हैं)।
अब मत रोको... विज्ञापन के बाद और भी बहुत कुछ है;)
आवर्त सारणी धातु
क्षारीय धातु
के तत्व हैं आवर्त सारणी का पहला स्तंभ, परिवार 1A. उन्हें क्षार धातु कहा जाता है, क्योंकि पानी के साथ मिश्रित होने पर, वे हाइड्रॉक्साइड बनाते हैं, अर्थात एक क्षारीय (मूल) घोल।
आप तत्वों जो इस समूह से संबंधित हैं:
लिथियम (ली)
सोडियम (पर)
पोटैशियम (क)
रूबिडियम (आरबी)
सीज़ियम (सीएस)
फ़्रांसिओ (Fr)
क्षार धातुओं का उदासीन अवस्था (अनचार्ज/आयनित) में इलेक्ट्रॉनिक विन्यास केवल प्रस्तुत करता है अंतिम कोश में एक इलेक्ट्रॉन (संयोजकता परत). हे परमाणु किरण और इन धातुओं की प्रतिक्रियाशीलता ऊपर से नीचे की ओर बढ़ती है (देखने से) आवर्त सारणी). उनके पास अन्य धातुओं की तुलना में कम गलनांक होता है, वे निंदनीय होते हैं और बहुत घने नहीं होते हैं, के कारण एक मैट पहलू होता है उच्च ऑक्सीकरण क्षमता.
यह भी देखें:पदार्थ के गुण क्या हैं?
क्षारीय पृथ्वी धातु
ये ऐसे तत्व हैं जो में दिखाई देते हैं आवर्त सारणी का दूसरा स्तंभ, परिवार 2A. कहा जाता है क्षारीय मृदा एक बुनियादी (क्षारीय) चरित्र के समाधान बनाने की प्रवृत्ति से, और मिट्टी के लोगों के कारण, क्योंकि 19 वीं शताब्दी से पहले, इन पदार्थों द्वारा गठित ऑक्साइड को इस तरह से नामित किया गया था। इस शब्द का उपयोग गैर-अघुलनशील धातुओं को नामित करने के लिए किया गया था, जो गर्म होने पर उत्परिवर्तन नहीं करते थे, समूह 2 तत्वों की सामान्य विशेषताएं। बाद में, नए शोध और प्रयोगों के आलोक में, यह पता चला कि "पृथ्वी" तत्व वास्तव में धातुओं द्वारा निर्मित ऑक्साइड थे।
वे निंदनीय धातु हैं, जिनमें कम घनत्व होता है इसके सबसे बाहरी कोश में दो इलेक्ट्रॉन, तापमान और दबाव की सामान्य परिस्थितियों में ठोस अवस्था में पाए जाते हैं। इस समूह से संबंधित हैं:
फीरोज़ा (बी)
मैगनीशियम (एमजी)
कैल्शियम (यहाँ)
स्ट्रोंटियम (श्रीमान)
बेरियम (बी 0 ए)
रेडियो (मेंढक)
संक्रमण धातुओं
तैयार करो आवर्त सारणी का समूह बी, और क्षारीय पृथ्वी धातुओं और के बीच स्थित हैं located अधातु. उन्हें IUPAC द्वारा ऐसे तत्वों के रूप में परिभाषित किया गया था जिनमें एक अपूर्ण एनर्जेटिकैड 'एनर्जेटिक सबलेयर होता है। अवधि "संक्रमण धातुओं" को संदर्भित करता है समूह 2 से 13. में संक्रमण आवर्त सारणी में और 'डी' कक्षीय में इलेक्ट्रॉनों का बढ़ता योग।
संक्रमण धातु समूह उच्च गलनांक और क्वथनांक के साथ घने तत्वों से बना होता है, और समूह 1 और 2 धातुओं की तुलना में कम प्रतिक्रियाशील (परिवार 1ए और 2ए)। संक्रमण धातुओं में टंगस्टन हैं, जो उच्चतम गलनांक (3422 डिग्री सेल्सियस) वाला तत्व है, और पारा (एचजी), जो एक धातु है जो तापमान और दबाव की सामान्य परिस्थितियों में तरल होती है, इसका गलनांक (-38.83 °C) होता है।
संक्रमण धातुओं में विभिन्न ऑक्सीकरण अवस्थाएँ होती हैं (एनओएक्स चर) और रंगीन पदार्थ बनाते हैं।

आंतरिक संक्रमण तत्व
आंतरिक संक्रमण तत्व वो हैं:
लैंथेनाइड्स: तत्वों से बनी श्रृंखला जिसमें 57 से 71 प्रोटॉन होते हैं और प्रोमेथियम के अपवाद के साथ, प्राकृतिक होते हैं।
एक्टिनाइड्स: परमाणु क्रमांक 89 से 103 तक के तत्वों द्वारा गठित समूह और जो अधिकांश भाग के लिए सिंथेटिक हैं। इस समूह के सभी हैं रेडियोधर्मी छोटे आधे जीवन के साथ।
इन दो समूहों के तत्वों का गलनांक उच्च होता है और सभी कमरे के तापमान पर ठोस होते हैं।
अर्ध धातु
आप अर्धधातु कुल मिलाकर, सात तत्व हैं:
बोरॉन (बी)
सिलिकॉन (सी)
जर्मेनियम (जीई)
आर्सेनिक (के रूप में)
सुरमा (सोमवार)
टेल्यूरियम (ते)
पोलोनियम (पीओ)
यह वर्गीकरण उन तत्वों को दिया गया है जिनमें धातुओं के लिए प्रासंगिक भौतिक-रासायनिक विशेषताएं और गैर-धातु तत्वों से संबंधित अन्य भी. सेमीमेटल्स में चमक होती है, भंगुर यौगिक होते हैं, जो धनायनों और आयनों (स्थिति के आधार पर) बनाने में सक्षम होते हैं, और मध्यवर्ती कंडक्टर होते हैं।
धातुओं के प्रकार
लौह: पदार्थ जिनकी संरचना में लोहा होता है। वो हैं मिश्र धातु जिसमें एक सामान्य तत्व के रूप में लोहा होता है, लेकिन विभिन्न सांद्रता के साथ तैयार किया जा सकता है कार्बन, उदाहरण के लिए, या विभिन्न तकनीकों के साथ जाली, इस प्रकार विभिन्न भौतिक गुणों वाले उत्पाद हैं।
अलौह: अन्य प्रकार की धातुओं से बनने वाली मिश्रधातुएँ, जैसे अल्युमीनियम, तांबा, निकल, जस्ता, टाइटेनियम.
भारी धातुओं: सीसा, निकल, जस्ता, पारा। वे प्रतिक्रियाशील, विषाक्त और जैव संचयी धातुएं हैं। उनका उपयोग बैटरी, लैंप, युद्ध की कलाकृतियों के लिए गोला-बारूद, अन्य में किया जाता है।
धातुओं के रासायनिक बंधन
धातु हैं तत्वों विद्युत धनअर्थात् उनमें रासायनिक बंधन में इलेक्ट्रॉनों को खोने की प्रवृत्ति होती है। जब कोई धातु किसी अधातु के साथ परस्पर क्रिया करती है, तो यह एक आयनिक बंधन निष्पादित करें में अंतर के कारण वैद्युतीयऋणात्मकता. धातुओं के लिए अन्य बंधन संभावना धातु बंधन है।
पर धातु कनेक्शन धातुओं के बीच होता है, इलेक्ट्रॉनों की आंशिक रिहाई और परमाणुओं के चारों ओर एक बादल या इलेक्ट्रॉनों के समुद्र के निर्माण के साथ, जो धातु भागों के गुणों की गारंटी देता है प्रवाहकत्त्व विद्युत और लचीलापन।
यह भी देखें: कंडक्टर और इंसुलेटर - क्या अंतर हैं?
धातु प्राप्त करना
अधिकांश धातुएं प्राकृतिक रूप से पाई जाती हैं अन्य तत्वों से जुड़ी चट्टानें और खनिज. धातुओं को परिष्कृत करने के लिए कई तकनीकें हैं, जैसे इलेक्ट्रोलिसिस और अलग-अलग यौगिकों के लिए रासायनिक प्रतिक्रियाओं के माध्यम से।
धातुओं के मामले में, धातु में एक निश्चित डिग्री की शुद्धता प्राप्त करने के लिए औद्योगिक पैमाने पर दो सबसे अधिक इस्तेमाल की जाने वाली तकनीकें हैं: का अंतर घनत्व और चुंबकीय संवेदनशीलता (प्रवृत्ति कि धातु को प्रतिक्रिया करनी पड़ती है a चुंबकीय क्षेत्र).

हल किए गए अभ्यास
प्रश्न 1 - (एनेम) बैटरियों में मौजूद कैडमियम जमीन तक पहुंच सकता है जब इन सामग्रियों को पर्यावरण में अनियमित रूप से निपटाया जाता है या जब उन्हें जलाया जाता है। धात्विक रूप के विपरीत, Cd2+ आयन शरीर के लिए अत्यंत खतरनाक होते हैं क्योंकि वे प्रतिस्थापित कर सकते हैं Ca2+ आयन, हड्डियों में एक अपक्षयी रोग का कारण बनते हैं, जिससे वे बहुत छिद्रपूर्ण हो जाते हैं और हड्डियों में तेज दर्द होता है। जोड़। वे Zn2+ धनायन द्वारा सक्रिय एंजाइमों को भी रोक सकते हैं, जो कि गुर्दे के कामकाज के लिए अत्यंत महत्वपूर्ण हैं। यह आंकड़ा कुछ धातुओं और उनके संबंधित धनायनों की त्रिज्या में भिन्नता को दर्शाता है।
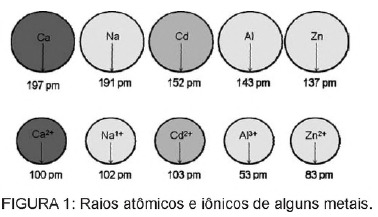
पाठ के आधार पर, कैडमियम की अपने आयनिक रूप में विषाक्तता इस तत्व का एक परिणाम है
ए) कम आयनीकरण ऊर्जा मौजूद है, जो आयन के गठन के पक्ष में है और अन्य यौगिकों के लिए इसके बंधन की सुविधा प्रदान करती है।
बी) में +1 से +3 तक के आवेशों वाले धात्विक धनायनों द्वारा मध्यस्थता वाली जैविक प्रक्रियाओं में कार्य करने की प्रवृत्ति होती है।
सी) एक त्रिज्या और चार्ज धातु आयनों के अपेक्षाकृत करीब है जो जैविक प्रक्रियाओं पर कार्य करते हैं, जिससे इन प्रक्रियाओं में हस्तक्षेप होता है।
डी) एक बड़ा आयनिक त्रिज्या है, जो इसे जैविक प्रक्रियाओं में हस्तक्षेप करने की इजाजत देता है जिसमें छोटे आयन सामान्य रूप से भाग लेते हैं।
ई) में +2 चार्ज होता है, जो इसे जैविक प्रक्रियाओं में हस्तक्षेप करने की अनुमति देता है, जिसमें सामान्य रूप से, कम चार्ज वाले आयन भाग लेते हैं।
संकल्प
वैकल्पिक सी. कैडमियम धातु आयनों के समान एक तत्व है जो हमारे शरीर में स्वाभाविक रूप से होता है। जैव संचयी होने के अलावा, कैडमियम, धात्विक समूहों के समान होने के कारण, अणुओं के सल्फहाइड्रील समूहों से बंध सकता है। प्रोटीन का, इस प्रकार जैविक प्रक्रियाओं में परिवर्तन का कारण बनता है, जैसे कि डीकैल्सीफिकेशन, और ऊतक और लाल रक्त कोशिका विनाश रक्त।
प्रश्न 2 - धातुओं से संबंधित विशेषताओं के लिए, गलत विकल्प पर निशान लगाएं।
ए) अधिकांश धातुएं अच्छे विद्युत और थर्मल कंडक्टर हैं।
बी) कुछ धातुएं ऑक्सीकरण और/या कमी के लिए अतिसंवेदनशील होती हैं।
सी) लोहा एक प्रतिरोधी और निंदनीय धातु है, यानी इसे ढालना आसान है।
डी) क्षारीय पृथ्वी धातुओं का यह नाम "पृथ्वी" है, इन धातुओं के ऑक्साइड का जिक्र है, जो गहरे रंग के होते हैं।
ई) ऑक्सीकरण की क्रिया के कारण धातु विभिन्न रंगों के तत्व हैं और सुस्त हैं।
संकल्प
वैकल्पिक ई. धातुएं स्वाभाविक रूप से चमकदार और रंग में धात्विक होती हैं, वे ऑक्सीकरण से गुजर सकती हैं, जिससे संबंधित विशेषताओं में परिवर्तन होता है भाग का पहलू है, लेकिन यह एक घटना नहीं है जो सभी धातुओं में होती है, और, कुछ मामलों में, ऑक्सीकरण कई कारकों पर निर्भर करता है बाहरी।
लेसा बर्नार्डेस द्वारा
रसायन विज्ञान शिक्षक