प्रतिक्रिया की गति का नियम पदार्थ की मात्रा (mol/L) में अभिकर्मकों की सांद्रता के साथ एक रासायनिक परिवर्तन की गति से संबंधित है, जिसे निम्नानुसार कहा जा सकता है:

उदाहरण के लिए, निम्नलिखित सामान्य प्रतिक्रिया पर विचार करें:
एए + बीबी → सीसी + डीडी
मान लीजिए कि हम अभिकारकों A और B की सांद्रता बढ़ाते हैं, प्रतिक्रिया की गति का क्या होगा? ठीक है, जैसे-जैसे एक ही स्थान में अभिकारक कणों की मात्रा बढ़ेगी, उनके बीच अधिक प्रभावी टकराव होंगे, जिसके परिणामस्वरूप प्रतिक्रिया विकास की दर में वृद्धि होगी। यानी इससे आपकी स्पीड बढ़ जाएगी।
इसलिए, प्रतिक्रिया दर अभिकारकों की सांद्रता के सीधे आनुपातिक होती है। हालांकि, यह तापमान पर भी निर्भर करता है। इसलिए, हमारे पास निम्नलिखित गणितीय समीकरण है जो प्रतिक्रिया गति के नियम का प्रतिनिधित्व करता है:

किस पर:
वी = प्रतिक्रिया गति;
k = स्थिरांक जो केवल तापमान मान पर निर्भर करता है;
α और β = प्रयोगात्मक रूप से निर्धारित घातांक।
केवल जब प्रतिक्रिया प्राथमिक होती है, अर्थात यह एक ही चरण में होती है, तो घातांक संतुलित रासायनिक समीकरण के गुणांक के बिल्कुल बराबर होते हैं: वी = के. [द]. [बी]ख
. हालांकि, अन्य मामलों में, उपयुक्त क्षमता जिसके लिए प्रत्येक अभिकर्मक की एकाग्रता को बढ़ाया जाना चाहिए, प्रयोगात्मक रूप से निर्धारित किया जाना चाहिए।अब मत रोको... विज्ञापन के बाद और भी बहुत कुछ है;)
प्रतिक्रियाओं की गति के नियम को कई नामों से जाना जाता है, यहाँ कुछ हैं: मास एक्शन का कानून, रैपिडिटी का समीकरण, काइनेटिक लॉ ऑफ रिएक्शन और गुल्डबर्ग-वेज लॉ।
इस कानून को कैसे लागू किया जाए, इसके एक उदाहरण पर विचार करें:
निम्नलिखित प्राथमिक प्रतिक्रिया पर विचार करें:
2 एचसीएल (छ) → एच2(जी) + क्ल2(जी)
ए) इस प्रतिक्रिया की गति के लिए समीकरण लिखें;
बी) प्रयोगों के माध्यम से, इस हाइड्रोजन क्लोराइड गैस अपघटन प्रतिक्रिया की गति और 25 डिग्री सेल्सियस के निरंतर तापमान पर इस अभिकर्मक की एकाग्रता को नीचे दी गई तालिका में नोट किया गया था:
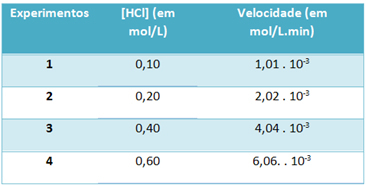
इसके आधार पर, उल्लिखित तापमान पर इस प्रतिक्रिया की विशेषता वेग स्थिरांक निर्धारित करें।
संकल्प:
द) वी = के. [एचसीएल]2
बी) वी = के। [एचसीएल]2
कश्मीर = __वी___
[एचसीएल]2
कश्मीर = 1,01. 10-3 मोल. ली-1. मिनट-1
0.01 मोल। ली-1
कश्मीर = 1.01। 10-1 मिनट-1
"बी" अक्षर को हल करने के लिए, आप किसी भी प्रयोग के डेटा का उपयोग कर सकते हैं कि प्राप्त मूल्य समान होगा।
लेकिन क्या होगा अगर प्रतिक्रिया प्राथमिक नहीं है? गैर-प्राथमिक प्रतिक्रियाओं में इस तरह के प्रश्नों को हल करना कैसे संभव होगा? कैसे पता लगाने के लिए, गैर-प्राथमिक प्रतिक्रियाओं के लिए वेग का नियम पढ़ें।
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
क्या आप इस पाठ को किसी स्कूल या शैक्षणिक कार्य में संदर्भित करना चाहेंगे? देखो:
FOGAÇA, जेनिफर रोचा वर्गास। "रासायनिक प्रतिक्रियाओं की गति का नियम"; ब्राजील स्कूल. में उपलब्ध: https://brasilescola.uol.com.br/quimica/lei-velocidade-das-reacoes-quimicas.htm. 27 जून, 2021 को एक्सेस किया गया।


