NS घुलनशीलताके रूप में परिभाषित किया जा सकता है किसी दिए गए तापमान पर एक निश्चित मात्रा में विलायक में घुलने वाले विलेय की अधिकतम संभव मात्रा।
यह अधिकतम राशि जिसे भंग किया जा सकता है, के रूप में भी जाना जाता है घुलनशीलता गुणांक या घुलनशीलता डिग्री. लेकिन किसी भी पदार्थ की घुलनशीलता अन्य बातों के अलावा, विलायक के प्रकार पर निर्भर करती है जिसमें विलेय बिखरा हुआ है।
उदाहरण के लिए, NaCl (सोडियम क्लोराइड - टेबल सॉल्ट) पानी में बहुत घुलनशील है, और 20ºC पर 1 लीटर पानी में, हम इस नमक के 360 ग्राम तक घोल सकते हैं। लेकिन जब विलायक गैसोलीन में बदल जाता है, तो समान मात्रा, तापमान और दबाव की स्थिति में, नमक भंग नहीं होता है।
किसी पदार्थ की विलेयता एक विलायक से दूसरे विलायक में इतनी भिन्न क्यों होती है?
कारकों में से एक है polarity शामिल यौगिकों में से। उद्धृत उदाहरण में, हमारे पास है कि नमक ध्रुवीय है, पानी ध्रुवीय है, और गैसोलीन गैर-ध्रुवीय है। नमक सोडियम (Na) और क्लोरीन (Cl) के परमाणुओं से बनता है जो आयनिक बंधों के माध्यम से बंधते हैं, जिसमें सोडियम निश्चित रूप से क्लोरीन को एक इलेक्ट्रॉन दान करता है, जिससे Na आयन बनता है।
+ और क्लू-. चूँकि इन आयनों पर विपरीत आवेश होते हैं, इसलिए वे आकर्षित होते हैं और एक साथ पकड़ते हैं (Na .)+NS-).
इससे हमें पता चलता है कि नमक वास्तव में ध्रुवीय है, प्रत्येक आयनिक बंधन ध्रुवीय है, क्योंकि यौगिक में विद्युत आवेश में अंतर होता है।
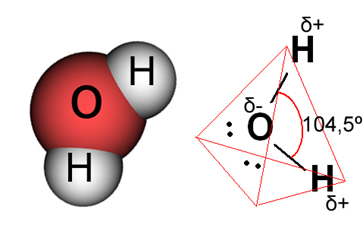
पानी के मामले में, मौजूदा बंधन सहसंयोजक है, जिसमें दो हाइड्रोजन परमाणु ऑक्सीजन परमाणु के साथ इलेक्ट्रॉनों को साझा करते हैं। पानी के अणु में दो द्विध्रुव होते हैं, ऑक्सीजन में आंशिक रूप से नकारात्मक चार्ज होता है और हाइड्रोजन में आंशिक रूप से सकारात्मक चार्ज होता है (δ .)- ओ एच+). लेकिन, ये द्विध्रुव एक दूसरे को रद्द नहीं करते हैं, क्योंकि पानी का अणु 104.5º के कोण पर मिलता है, यह दर्शाता है कि अणु के साथ वितरण और चार्ज एक समान नहीं है। अणु के ऑक्सीजन परमाणु पर ऋणात्मक आवेश घनत्व अधिक होता है। इससे हमें पता चलता है कि पानी का अणु वास्तव में ध्रुवीय है।
अब मत रोको... विज्ञापन के बाद और भी बहुत कुछ है;)
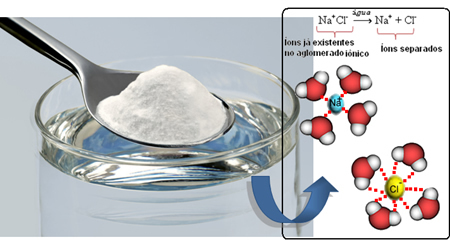
इसलिए जब हम नमक को पानी में मिलाते हैं, तो नमक का सकारात्मक हिस्सा, जो कि Na धनायन है।+, पानी के नकारात्मक भाग से आकर्षित होता है, जो कि ऑक्सीजन है, और नमक का नकारात्मक भाग (Cl आयनों .)-) पानी के सकारात्मक भाग (H .) से आकर्षित होता है+). नतीजतन, संघ Na+NS- यह टूट जाता है, पानी में नमक घोलता है।
दूसरी ओर, गैसोलीन विभिन्न हाइड्रोकार्बन के मिश्रण से बनता है, जो गैर-ध्रुवीय होते हैं, अर्थात गैसोलीन के विद्युत आवेश का वितरण एक समान होता है। इस प्रकार, गैसोलीन के साथ नमक आयनों की कोई बातचीत नहीं होती है और यह भंग नहीं होता है।
ये और इसी तरह के अन्य मामले हमें निम्नलिखित निष्कर्ष पर ले जाते हैं:

हालाँकि, इसे एक सामान्य नियम नहीं माना जा सकता है, क्योंकि गैर-ध्रुवीय विलेय के कई मामले हैं जो ध्रुवीय सॉल्वैंट्स में अच्छी तरह से घुल जाते हैं और इसके विपरीत। तो, यह समझने के लिए कि ऐसा क्यों होता है, हमें एक और कारक पर विचार करना होगा: का प्रकार अंतर-आणविक बल विलायक और विलेय का।
पाठ में इसके बारे में कानून: "अंतर-आणविक शक्ति और पदार्थों की घुलनशीलता के बीच संबंध”.
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
क्या आप इस पाठ को किसी स्कूल या शैक्षणिक कार्य में संदर्भित करना चाहेंगे? नज़र:
FOGAÇA, जेनिफर रोचा वर्गास। "ध्रुवीयता और पदार्थों की घुलनशीलता के बीच संबंध"; ब्राजील स्कूल. में उपलब्ध: https://brasilescola.uol.com.br/quimica/relacao-entre-polaridade-solubilidade-das-substancias.htm. 27 जुलाई, 2021 को एक्सेस किया गया।


