जैसा कि ग्रंथों में दिखाया गया है "रासायनिक तत्वों का विद्युतचुंबकीय स्पेक्ट्रम" तथा "उत्सर्जन और अवशोषण स्पेक्ट्रा और किरचॉफ के नियम”, प्रत्येक रासायनिक तत्व का असंतत उत्सर्जन स्पेक्ट्रा अलग है।

तो, नीचे हमारे पास इनमें से कुछ तत्वों का विशिष्ट स्पेक्ट्रा है:

इस प्रकार, डेनिश भौतिक विज्ञानी नील्स बोहर (1885-1962) ने महसूस किया कि यह इनमें से प्रत्येक तत्व के परमाणु की संरचना से संबंधित हो सकता है। इसलिए उन्होंने एक परमाणु मॉडल का प्रस्ताव रखा जो रदरफोर्ड के मॉडल का पूरक था, लेकिन परमाणु के नाभिक में आसपास के इलेक्ट्रॉनों के व्यवहार पर ध्यान केंद्रित किया।
कुछ समय पहले मैक्स प्लैंक (1858-1947) ने एक सिद्धांत प्रस्तावित किया था कि इलेक्ट्रॉन होते हैं मात्रा निर्धारित, इस अर्थ में कि वे विशिष्ट मात्रा में ऊर्जा का उत्सर्जन और अवशोषण, जैसे कि वे ऊर्जा के छोटे पैकेट थे packet, जिसे उन्होंने बुलाया कितना (मात्रा, एकवचन में)।
इस प्रकार, बोहर ने निम्नलिखित का प्रस्ताव रखा: चूंकि प्रत्येक तत्व का एक अलग स्पेक्ट्रम होता है, इसलिए प्रत्येक तत्व के परमाणु में स्थिर और अलग-अलग ऊर्जा वाले तत्व होते हैं।
प्रत्येक इलेक्ट्रॉन केवल एक विशिष्ट विशिष्ट कक्षा में ही रह सकता है, क्योंकि इनमें से प्रत्येक कक्षा में इलेक्ट्रॉन की स्थिर, अच्छी तरह से परिभाषित और विशिष्ट ऊर्जा होती है। इलेक्ट्रॉन केवल उस ऊर्जा स्तर पर कब्जा कर सकता है जिसके लिए उसके पास संबंधित ऊर्जा है।
अब मत रोको... विज्ञापन के बाद और भी बहुत कुछ है;)
स्पेक्ट्रा बंद हैं क्योंकि इलेक्ट्रॉनों की मात्रा निर्धारित की जाती है।
एक इलेक्ट्रॉन केवल स्तर बदल सकता है यदि वह ऊर्जा को अवशोषित करता है। उदाहरण के लिए, जब आप बन्सन बर्नर में सोडियम नमक जलाते हैं, तो आप इलेक्ट्रॉनों को ऊर्जा प्रदान कर रहे होते हैं। ऊर्जा की मात्रा को अवशोषित करते समय, इलेक्ट्रॉन उत्तेजित अवस्था में रहते हुए एक और अधिक ऊर्जावान स्तर पर कूद जाता है। हालांकि, जमीन की स्थिति अधिक स्थिर है, इसलिए यह इलेक्ट्रॉन अवशोषित ऊर्जा का उत्सर्जन करता है और अपनी मूल कक्षा में वापस आ जाता है। यह इस ऊर्जा को विद्युत चुम्बकीय तरंगों के रूप में उत्सर्जित करता है जिसे प्रकाश के रूप में देखा जा सकता है। सोडियम के मामले में, यह प्रकाश गहरे पीले रंग का होता है। इस प्रकार, जब ये तरंगें एक प्रिज्म से गुजरती हैं, तो सोडियम का असंतत स्पेक्ट्रम प्राप्त होता है।
तो बोहर के लिए, प्रत्येक चमकदार रेखा जो तत्वों के असंतत स्पेक्ट्रम में दिखाई देती है, उस ऊर्जा को इंगित करती है जब इलेक्ट्रॉन एक बाहरी स्तर से नाभिक के करीब एक बाहरी स्तर पर लौटता है।
नीचे दिया गया आंकड़ा इस मुद्दे को बेहतर ढंग से समझने में मदद करता है:
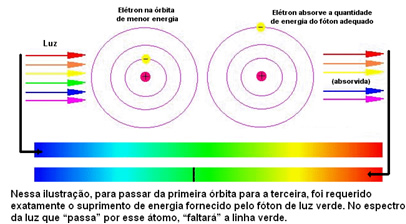
चूंकि प्रत्येक तत्व के परमाणुओं को केवल कुछ ऊर्जा मूल्यों की अनुमति होती है जो ऊर्जा परतों के अनुरूप होते हैं, प्रत्येक तत्व के लिए एक अलग स्पेक्ट्रम होता है।
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
क्या आप इस पाठ को किसी स्कूल या शैक्षणिक कार्य में संदर्भित करना चाहेंगे? देखो:
FOGAÇA, जेनिफर रोचा वर्गास। "विद्युत चुम्बकीय स्पेक्ट्रा और परमाणु संरचना"; ब्राजील स्कूल. में उपलब्ध: https://brasilescola.uol.com.br/quimica/espectros-eletromagneticos-estrutura-atomo.htm. 27 जून, 2021 को एक्सेस किया गया।

