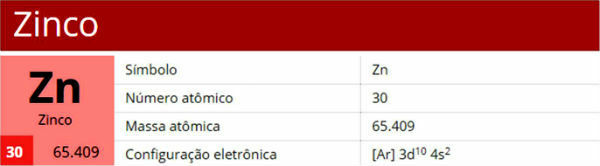
Réactions de déplacement, aussi appelé réactions de substitutionou encore de échange simple, sont celles qui se produisent lorsqu'une substance simple (formée d'un seul élément) réagit avec une substance composée, « déplaçant » cette dernière dans une nouvelle substance simple.
Génériquement, on peut le définir comme suit :
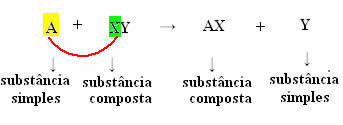
Mais pour que cela se produise, la substance simple, dans le cas symbolisé par A, doit être plus réactif que l'élément qui sera déplacé du composé, se transformant en une nouvelle substance simple (Y).
Regardons un exemple où cette réaction se produit :
Observez l'expérience ci-dessous dans laquelle une feuille de zinc (Zn) est placée dans une solution aqueuse de sulfate de cuivre (CuSO4). Au fil du temps, on constate que la solution de sulfate de cuivre passe d'une couleur bleue à un bleu moins intense, car elle se décolore et il y a un dépôt de cuivre sur la feuille de zinc.

Nous pouvons représenter cette réaction en utilisant l'équation chimique suivante :

Notez que le zinc a déplacé le cuivre, ce qui signifie que le zinc est le plus réactif.
Étant donné que les deux sont des métaux, nous pouvons vérifier si la réaction d'échange simple se produira ou non en analysant le file d'attente de réactivité en métal indiqué ci-dessous:
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)

Notez que le cuivre est en fait moins réactif que le zinc, donc si nous décidons de faire le contraire de l'expérience précédente et mettre une feuille de cuivre dans une solution de sulfate de zinc, la réaction ne se produirait pas, car le cuivre ne pourrait pas déplacer le zinc.
Les réactions de déplacement sont un type de réaction redox, car il y a un transfert d'électrons de la substance simple au composite. Dans le processus expliqué ci-dessus, le zinc était initialement sous sa forme neutre, qui est métallique, et fait partie d'un composé dans lequel il a une charge 2+, c'est-à-dire que chaque atome de zinc a perdu deux électrons. Avec le cuivre, c'est l'inverse qui se produit, il reçoit deux électrons pour passer à l'état solide métallique.
Dans le cas d'une simple réaction d'échange avec des non-métaux, il est considéré: la réaction ne se produira que si le non-métal le plus réactif est la substance simple qui peut déplacer un autre non-métal moins réactif. La réactivité des amétaux est indiquée ci-dessous :

Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Réactions de déplacement, de substitution ou d'échange simple »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/reacoes-deslocamento-substituicao-ou-simples-troca.htm. Consulté le 28 juin 2021.