L'électrolyse est un procédé largement utilisé par l'industrie chimique, car il permet d'obtenir substances qui n'existent pas à l'état libre, telles que le chlore, l'iode, la soude caustique, parmi autres.
L'électrolyse est le contraire de la cellule, dans laquelle l'électricité est obtenue par des réactions redox, c'est-à-dire que l'énergie chimique est transformée en énergie électrique. Déjà en électrolyse, l'électricité est utilisée pour produire des réactions d'oxydoréduction et de l'énergie chimique.
D'où l'origine de son nom, étant que électro signifie "courant électrique" et lyse signifie "pause". C'est exactement ce qui se passe, le courant électrique coupe ou décompose la substance qui lui est soumise.
La batterie est un processus spontané, l'électrolyse, cependant, c'est un processus non spontané, qui doit être démarré au moyen d'un courant électrique.
Il existe deux types d'électrolyse: une ardent et le en milieu aqueux. Dans ce texte, nous traiterons le premier cas.
La différence entre l'électrolyse ignée et l'électrolyse en milieu aqueux est la forme sous laquelle se trouve la substance qui sera soumise au courant électrique.
Dans le cas de l'électrolyse ignée, la substance ionique est à l'état liquide, c'est-à-dire fondue, sans la présence d'eau. Le mot « fougueux » vient du latin ardent, qui signifie "brûlant, enflammé".En électrolyse, on utilise un récipient appelé Cuba ou alors cellule électrolytique, où deux électrodes sont montées à travers lesquelles le courant électrique passera. Les électrodes peuvent être inerte (ne pas changer pendant l'électrolyse) ou actif (Ils subissent une sorte de changement pendant l'électrolyse). Les plus utilisés sont les inertes en platine ou en graphite.
Les électrodes sont ensuite connectées à une source de courant continu (pile ou batterie). Le pôle négatif de la batterie fournira des électrons à l'une des électrodes, se chargeant négativement et attirera les cations (ions positifs) de la substance fondue. Parce qu'elle attire les cations, cette électrode négative est appelée cathode. Dans celui-ci, les cations reçoivent des électrons et se réduisent.
L'électrode positive attire les anions (ions négatifs) et, pour cette raison, elle s'appelle une anode. Les anions déchargent leurs électrons à l'anode, subissant une oxydation.
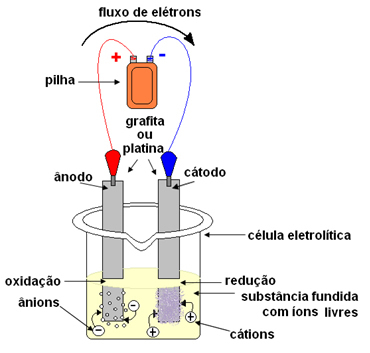
Dans les batteries, l'électrode positive est appelée cathode et la négative est l'anode. Ici en électrolyse c'est le contraire, l'anode est le pôle positif et la cathode est le pôle négatif. Cependant, dans les deux cas, dans la batterie et en électrolyse, à l'anode il y a oxydation et à la cathode il y a réduction.
Brièvement, nous avons :

Un autre fait important est que la cellule ou la batterie utilisée pour générer le courant électrique doit avoir un ddp (différence de potentiel) égal ou supérieur à la différence de potentiel de réaction.
Pour mieux comprendre comment se déroule le processus d'électrolyse et comment il décompose les substances produisant des éléments importants ou des substances simples, lisez le texte Électrolyse du chlorure de sodium igné.
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/eletrolise-Ignea.htm
