LES équation de Clapeyron est une expression mathématique qui relie des quantités telles que pression (P), le volume (V), la température (T) et le nombre de particules (n) qui composent un gaz parfait ou parfait. Cette équation porte le nom du physicien français PaulÉmileclapeyron et peut être compris comme une généralisation des lois empiriques de la des gazparfaitdansGay-Lussac, Charles et Boyle. Elle a été fondamentale pour l'étude des gaz parfaits et a permis l'évolution de Machines thermiques, ce qui les rend de plus en plus efficaces au cours des dernières décennies.
Voir aussi: Découvertes physiques qui se sont produites par accident
Équation de Clapeyron: loi des gaz parfaits
L'équation de Clapeyron est dérivé de trois lois empiriques, c'est-à-dire des lois déterminées à partir d'expériences. De telles lois expliquent le comportement des gaz dans transformations de gazisovolumétrique (loi Gay-Lussac), isobare (loi Charles) et isothermes (La loi de Boyle). Selon ces lois :
dans les métamorphoses
isovolumétrique, le rapport entre la pression et la température thermodynamique d'un gaz parfait reste constant ;dans les métamorphoses isobare, le rapport entre le volume et la température thermodynamique d'un gaz parfait est constant ;
- dans les métamorphoses isothermes, le produit de la pression et du volume d'un gaz parfait reste constant.
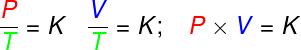
P – pression (Pa – pascal)
V – volume de gaz (m³)
T – température du gaz thermodynamique (K – kelvin)
A partir des trois lois ci-dessus, l'équation de Clapeyron détermine quelle est la valeur de cette constant (K) obtenu dans chacune des transformations susmentionnées. D'après l'équation de Clapeyron, cette constante est égale au nombre de moles multiplié par un R constant, appelée constante universelle des gaz parfaits, et égale à Constante de Boltzmann multiplié par Le numéro d'Avogadro.
Formule
Découvrez la formule connue sous le nom équationdansClapeyron :
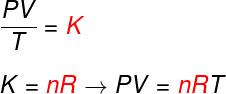
non – nombre de moles (mol)
R – constante universelle des gaz parfaits (R = 0,082 atm.l/mol. K ou 8,314 J.mol/K)
En analysant l'équation de Clapeyron, il est possible de voir que la pression exercée par les gaz parfaits est directement proportionnel à la température et aussi à nombre de moles. Par ailleurs, la pression est inversement proportionnelle au volume occupé par le gaz.
O modèle de gaz parfait rendu possible par l'équation de Clapeyron est largement utilisé pour la développement de machines alimentées par fluides, tels que les machines à vapeur et les moteurs à combustion interne.
Plusieurs résultats importants ont pu être obtenus à partir de l'équation de Clapeyron. L'un d'eux, par exemple, prédit qu'une mole de n'importe quel gaz parfait occupe un volume de 22,4 litres lorsqu'il est soumis à la pression de 1 guichet automatique (1,01.105 Pa) et à la température de 273K (0°C).
Voir aussi: Concepts les plus importants en thermologie
Exercices résolus sur l'équation de Clapeyron
Question 1 —(UECE) Un gaz dont la température, le volume et la pression peuvent être liés par PV = nRT a les caractéristiques suivantes :
a) très grande distance moyenne entre les molécules afin de ne pas tenir compte des interactions intermoléculaires, sauf en cas de collision; les molécules subissent des collisions élastiques.
b) très petite distance moyenne entre les molécules; les molécules subissent des collisions inélastiques.
c) très grande distance moyenne entre les molécules afin de ne pas tenir compte des interactions intermoléculaires, sauf en cas de collision; les molécules subissent des collisions inélastiques.
d) très grande distance moyenne entre les molécules et avec de fortes interactions intermoléculaires; les molécules subissent des collisions élastiques.
Résolution:
Dans le modèle des gaz parfaits, un grand nombre de particules sans dimension se déplacent à grande vitesse dans des directions aléatoires. La seule interaction subie par ces particules sont des collisions parfaitement élastiques, donc la bonne alternative est lettre a.
Question 2 —(UFRGS) Considérez les déclarations suivantes sur les gaz parfaits.
JE. La constante R présente dans l'équation d'état pour les gaz pV = nRT a la même valeur pour tous les gaz parfaits.
II. Des volumes égaux de différents gaz parfaits, à la même température et pression, contiennent le même nombre de molécules.
III. L'énergie cinétique moyenne des molécules d'un gaz parfait est directement proportionnelle à la température absolue du gaz.
Lesquelles sont correctes ?
a) Seulement moi
b) Seulement II
c) Seulement III
d) Seulement I et II
e) I, II et III
Modèle:
Regardons les alternatives :
JE. corriger, c'est pourquoi on l'appelle la constante universelle des gaz parfaits.
II. corriger. Selon l'équation de Clapeyron, si deux gaz parfaits ont la même pression, la même température et le même volume, alors le nombre de particules dans ces gaz est égal.
III. corriger. Selon le théorème d'équipartition énergétique, l'énergie cinétique des particules dans un gaz parfait est proportionnelle à sa température.
Par conséquent, la bonne alternative est la lettre e.
Question 3 - (UFJF) Des hommes comme Clapeyron, Boyle, Mariotte, Gay-Lussac, van der Walls, entre autres, ont développé d'importantes études portant sur les propriétés des gaz. Le comportement des gaz réels se rapproche des gaz idéaux dans des conditions de basse pression, ainsi que des gaz contenus dans un grand volume et des gaz maintenus à des températures élevées. Considérons que, dans une expérience de laboratoire, un récipient de volume V est complètement fermé et contient 1 mol d'un gaz parfait sous une pression de 4,0 atm est soumis à une détente à une température constante égale à 127 º C et que le comportement de ce gaz est celui d'un gaz parfait, comme indiqué dans graphique.
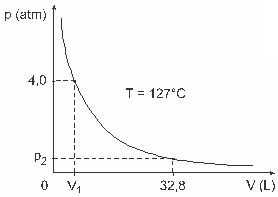
Dans ce cas, lorsque le gaz occupe un volume égal à 32,8 L, la pression qu'il exerce sera :
(Donné: la constante universelle des gaz parfaits est R = 0,082 atm. L/mol. K.)
a) 0,32 atm
b) 0,40 atm
c) 1,0 guichet automatique
d) 2,0 guichets automatiques
e) 2,6 atm
Résolution:
Lettre C.
Pour résoudre l'exercice, nous devons appliquer les données à l'équation de Clapeyron, mais avant cela, nous devons transformer la température, qui est en degrés Celsius, en kelvin. Vérifier:

Par Rafael Hellerbock
Professeur de physique
La source: École du Brésil - https://brasilescola.uol.com.br/fisica/a-equacao-clapeyron.htm



