Les oxydes sont des composés binaires, c'est-à-dire formés de seulement deux éléments chimiques, dont le plus électronégatif est l'oxygène. Voir ci-dessous quelques-uns des oxydes les plus importants présents dans notre vie quotidienne :
- Oxyde de calcium (CaO) :
Ce composé est une poudre blanche connue sous le nom de chaux vive ou chaux vive qui, lorsqu'elle réagit avec de l'eau, donne naissance à de l'hydroxyde de calcium (Ca(OH)2), appelée chaux éteinte, chaux éteinte ou chaux hydratée. Cette base est utilisée pour la peinture de type badigeon sur les murs, la protégeant des infiltrations, et sur les arbres pour repousser les insectes.

L'oxyde de calcium est largement utilisé en agriculture pour corriger le pH des sols acides. Cependant, il faut faire attention à la façon dont cette application est réalisée, car le CaO réagit avec l'eau présente sur notre peau et produit des brûlures. En outre, il provoque également des dommages aux voies respiratoires et peut provoquer la cécité.
D'autres applications de CaO sont: dans les constructions, dans la préparation de mortier, de ciment et de céramique; dans la fabrication de briques métallurgiques, dans le traitement des eaux et des eaux usées, comme insecticide et fongicide, dans la purification des sucres, des huiles végétales et des jus de fruits, dans la production de verre, de Na
2CO3 et CaCl (ClO).- Oxyde de magnésium (MgO) :
Le MgO est une poudre blanche largement utilisée mélangée à de l'eau, formant une solution connue sous le nom de lait de magnésie. Il est utilisé comme antiacide gastrique car il réagit avec l'acide chlorhydrique dans notre estomac et neutralise l'environnement.

- Oxyde de silicium (SiO2):
le SiO2 il est connu sous le nom de silice et est présent dans le sable et se trouve également sous forme cristalline, comme le quartz, la topaze et l'améthyste.

La silice du sable est utilisée dans la production de verre, ainsi que le carbonate de sodium (Na2CO3) et calcaire (CaCO3). Lorsque ces composés sont chauffés à une température de 1500ºC, un mélange de silicates de sodium et de calcium se forme, qui est refroidi pour former le verre que nous connaissons.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
À2CO3 + CaCO3 + SiO2 → silicates de sodium et de calcium
frêne + calcaire + le sable → verre

- Monoxyde de carbone (CO) :
Le monoxyde de carbone est un gaz polluant et extrêmement toxique qui se dégage lors d'une combustion incomplète. L'exposition à ce gaz peut se produire par la pollution causée par la combustion de combustibles fossiles, tels que les produits pétroliers, et la fumée de cigarette.

Le CO est également utilisé dans les aciéries pour produire du fer métallique, réduisant l'oxyde de fer III à partir de l'hématite.
- dioxyde de carbone (CO2 – connu sous le nom de dioxyde de carbone) :
Il est l'un des principaux responsables des problèmes environnementaux tels que l'effet de serre, le réchauffement climatique et les pluies acides. Il est libéré lors de la combustion complète des carburants qui contiennent du carbone dans leur constitution et aussi par notre respiration.
C'est le gaz présent dans les boissons gazeuses et l'eau gazeuse. A l'état solide, on l'appelle glace carbonique et en raison de sa propriété de sublimation, c'est-à-dire en passant directement de l'état solide à l'état gazeux, il dégage une fumée blanche qui est souvent utilisée dans les concerts, les théâtres, les fêtes et des films.
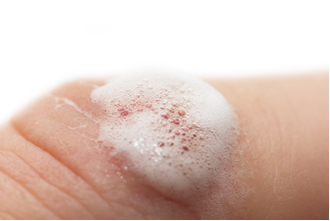
- Peroxyde d'hydrogène (H2O2):
En solution aqueuse, le peroxyde d'hydrogène est appelé peroxyde d'hydrogène et est utilisé (à 3 %) comme antiseptique et agent de blanchiment. À des concentrations plus élevées, il est utilisé pour éclaircir les cheveux et les cheveux; et à des concentrations supérieures à 30 %, il est utilisé dans des industries telles que l'eau de Javel, les fibres textiles et la propulsion des fusées.
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Principaux oxydes de la vie quotidienne »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/principais-Oxidos-cotidiano.htm. Consulté le 28 juin 2021.
Chimie

Les composés binaires, les peroxydes sont utilisés comme clarificateurs, agents de blanchiment des tissus, pâte de cellulose, préparation de mortier, chaux vive, glace sèche, peroxyde d'hydrogène, peroxyde d'hydrogène.
Chimie

Oxyde nitrique, lipophile, synthétisé par les cellules endothéliales, radical libre gazeux, procédés intracellulaire et extracellulaire, hémodilatation, élargissement des vaisseaux sanguins dans les muscles, suppléments aliments.

