Chaque cellule est un appareil dans lequel se produit une réaction d'oxydoréduction spontanée qui génère un courant électrique qui, à son tour, est utilisé pour faire fonctionner certains équipements.
Ces appareils tirent leur nom du fait que la première batterie créée a été inventée par Alessandro En 1800, il était formé de disques de zinc et de cuivre séparés par du coton imbibé de eau salée. Cet ensemble a été placé entremêlé, l'un sur l'autre, entassement les disques et formant une grande colonne. Comment était un la batterie de disques, a commencé à être appelé par ce nom.

Les batteries sont toujours constituées de deux électrodes et d'un électrolyte. L'électrode positive est appelée cathode et c'est là que la réaction de réduction. L'électrode négative est la anode et c'est là que la réaction de oxydation. L'électrolyte est aussi appelé pont de sel et est la solution conductrice d'ions.
Pour comprendre comment cela génère du courant électrique, voyez le cas de l'une des premières batteries, la
Le tas de Daniell, dans lequel se trouvait un récipient avec une solution de sulfate de cuivre (CuSO4(aq)) et, plongé dans cette solution, était une plaque de cuivre. Dans un autre récipient séparé, il y avait une solution de sulfate de zinc (ZnSO4(aq)) et une plaque de zinc trempé. Les deux solutions étaient reliées par un pont salin, qui était un tube de verre avec une solution de sulfate de potassium (K2SEUL4(aq)) avec de la laine de verre aux extrémités. Enfin, les deux plaques étaient reliées entre elles par un circuit extérieur, avec une lampe, dont l'éclairage indiquerait le passage du courant électrique :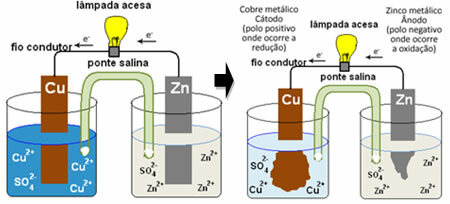
Ce qui se passe, c'est que le zinc a une plus grande tendance à s'oxyder, c'est-à-dire à perdre des électrons, de sorte que le zinc métallique de la lame fonctionne comme l'électrode négative, l'anode, où l'oxydation se produit: Zn( s ) Zn2+(ici) + 2 et-. Les électrons perdus par le zinc sont transportés par le circuit externe vers le cuivre, générant le courant électrique qui allume la lampe. Les ions cuivre de la solution reçoivent des électrons (réduisent) et se transforment en cuivre métallique qui se dépose sur la feuille de cuivre. Cela signifie que c'est l'électrode positive, la cathode, où se produit la réduction: Cul2+(ici) + 2 et- cul(s).
Les batteries d'aujourd'hui ont ce même principe de fonctionnement, dans lequel un métal donne des électrons à un autre, à travers une solution conductrice, et un courant électrique est produit. La différence est que les batteries utilisées aujourd'hui sont sèches, car elles n'utilisent pas de solution liquide comme électrolyte, comme cela se produit dans la batterie de Daniell.
Aujourd'hui, il existe une très grande variété de batteries qui sont vendues dans le commerce. Parmi eux, les plus courants sont les cellules acides (de Leclanché) et lepiles alcalines.
Les deux ont du zinc comme électrode négative; par contre, en pôle positif, il y a une barre de graphite installée au milieu du pieu entourée de dioxyde de manganèse (MnO2), du charbon de bois en poudre (C) et une pâte humide. La différence est que, dans la pile acide, le chlorure d'ammonium (NH) est utilisé dans la pâte humide.4Cl) et le chlorure de zinc (ZnCl2) - sels de caractère acide - en plus de l'eau (H2O). Dans la pile alcaline, on utilise de l'hydroxyde de potassium (KOH), qui est une base.

Les piles Leclanché sont les mieux adaptées aux équipements nécessitant une décharge légère et continue, tels que les télécommandes, les horloges murales, les radios portables et les jouets. Les piles alcalines, d'autre part, ont 50 à 100 % plus d'énergie qu'une pile ordinaire de même taille, étant recommandées pour les équipements qui nécessitent des téléchargements plus rapides et plus intenses tels que des radios, des lecteurs CD/DVD, des MP3 portables, des lampes de poche, des appareils photo numériques etc.

En savoir plus sur les électrolytes et les électrodes utilisés dans ces types de batteries et d'autres. quant aux types d'équipements qu'ils sont les plus recommandés, lire les articles connexes plus mugissement.
Par Jennifer Fogaça
Diplômé en Chimie


