Depuis l'antiquité, l'homme s'est intéressé à répondre à la question de la constitution de la matière.
Plusieurs personnalités de la communauté scientifique ont pris position sur le sujet, mais ce n'est qu'à la fin du XIXe siècle que les mystères de la composition atomique ont commencé à être percés.
L'ancien philosophe Leucippe, par exemple, croyait que l'atome était composé de minuscules particules.
Après cette définition, il a été proposé par Démocrite et Dalton que les particules atomiques étaient massives et indivisibles.
Ce fait a ensuite été contesté par Thomson, un physicien anglais qui a découvert l'existence de l'électron et a pu, alors, confirmer l'idée précédemment proposée par Leucipo.
Après cette découverte, Thomson a présenté un modèle dans lequel l'atome était formé d'une sphère de charges positives et à l'intérieur du noyau se trouvaient des électrons.
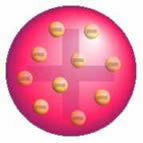
Modèle atomique de Thomson - Dans une sphère de masse chargée positivement et uniformément répartie,
ils seraient incrustés d'électrons chargés négativement, comme dans un pudding.
Même après la théorie de Thomson, le modèle atomique avait encore une déficience théorique-expérimentale, capable de prouver sa véracité.
Le sujet a été à nouveau chaleureusement discuté lorsque l'équipe du physicien Rutherford a noté qu'il y avait un très grand écart (et inexplicable, selon la théorie du pudding aux raisins) lorsque certaines particules alpha radioactives traversaient une fine couche de lamina métallique.
Après avoir analysé et étudié le fait, Rutherford est arrivé à la conclusion que le rayon de l'atome est 10 000 fois plus grand que le rayon du noyau.
À travers toute l'étude de l'atome, Rutherford et son équipe sont arrivés, en 1911, à un modèle atomique, qu'ils ont appelé le modèle planétaire de l'atome.

En 1913, Niels Bohr déchiffra le modèle atomique, appliquant le quantum d'action découvert par Planck à ses études. Le quantum d'action était, en fait, le grand joker qui viendrait compléter et clarifier le modèle atomique.
Bohr a ajusté efficacement et simplement le modèle présenté par Rutherford pour parvenir à la conclusion suivante :
L'électron acquiert de l'énergie, qui est représentée par une orbite définie. Les orbites autorisées forment les niveaux d'énergie.

Par Talita A. anges
Diplômé en Physique
Équipe scolaire du Brésil
La physique Moderne - La physique - École du Brésil
La source: École du Brésil - https://brasilescola.uol.com.br/fisica/do-atomo-rutherford-ao-atomo-bohr.htm
