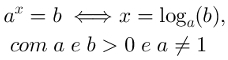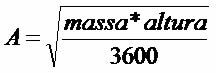Toi oxydes amphotères ce sont des oxydes qui ont un comportement ambigu, car contre un acide ils se comportent comme un oxyde basique; et en présence d'une base ils se comportent comme des oxydes acides.
Tant la base que l'acide avec lesquels réagissent les oxydes amphotères doivent être forts, avec un caractère chimique très prononcé.
Les oxydes amphotères sont généralement des solides ioniques, peu solubles dans l'eau, et lorsqu'ils réagissent avec ces acides et bases forts, ils produisent de l'eau et du sel.
D'une manière générale, nous avons :
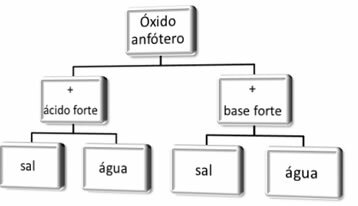
Schéma réactionnel des oxydes amphotères.
Ce qui suit sont des réactions impliquant deux oxydes amphotères, l'oxyde de zinc (ZnO) et l'oxyde d'aluminium (Al2O3). Notez comment dans certaines situations ils réagissent comme des acides et dans d'autres ils se présentent comme des bases :
1er cas: en cas de réaction avec des acides forts : se comportent comme des oxydes basiques, produisant du sel et de l'eau
Oxyde Acide Eau Salée
fort amphotère
(base)
ZnO(s) + H2SEUL4(aq) → ZnSO4(aq) + H2O(1)
Al2O3(s) + 6 HCl(ici) → 2 AlCl3(aq) + 3H2O(1)
2ème cas: en cas de réaction avec des bases fortes : se comportent comme des oxydes acides, produisant du sel et de l'eau
Eau salée à base d'oxyde
fort amphotère
(acide)
ZnO(s) + 2NaOH(ici) → Dans2ZnO2(aq) + H2O(1)
Al2O3(s) + 2 KOH(ici) → 2 KALO2(aq) + H2O(1)
Les principaux oxydes amphotères sont le zinc et l'aluminium; y compris l'oxyde de zinc (ZnO), également connu sous le nom alvaid, est une poudre blanche, amorphe, inodore, insoluble dans l'eau, mais soluble dans les solutions acides, qui est utilisée pour peindre les visages des clowns. Il est également utilisé comme astringent et écran solaire sous forme de lotion, de pommade et de gélatine.

Clown appliquant du badigeon (oxyde de zinc) comme maquillage
Il existe également des oxydes d'autres métaux (SnO et SnO2, PbO et PbO2) et les non-métaux (As2O3, À2O5, Sam2O3, Sam2O3).
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/oxidos-anfoteros.htm