Comme expliqué dans le texte Saturation des solutions, les solutions chimiques sont formées par la dissolution d'un soluté sur un solvant. Chaque soluté a un coefficient de solubilité spécifique, qui est la quantité maximale de soluté soluble dans une quantité donnée de solvant à un Température.
Construction d'un graphe avec courbe de solubilité
Par exemple, le coefficient de solubilité de KNO3 est de 31,2 g dans 100 g d'eau à 20°C. Si nous dissolvons exactement cette quantité de nitrate de potassium dans 100 g d'eau à 20°C, une solution saturée. Toute quantité supplémentaire de ce sel précipitera (formant un corps inférieur dans le récipient).

Cependant, le coefficient de solubilité varie avec la température. Donc, si nous chauffons cette solution saturée avec le corps inférieur KNO3, le précipité se dissoudra progressivement dans l'eau. Voir ci-dessous les valeurs des coefficients de solubilité KNO3 dans 100 g d'eau à différentes températures :
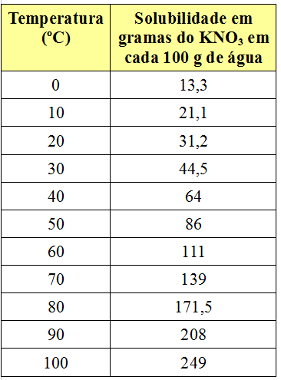
Notez que le solubilité de ce sel dans l'eau augmente avec l'augmentation de la température. Dans la plupart des substances, c'est également le cas. Si nous mettons ces valeurs dans un graphique, nous aurons :
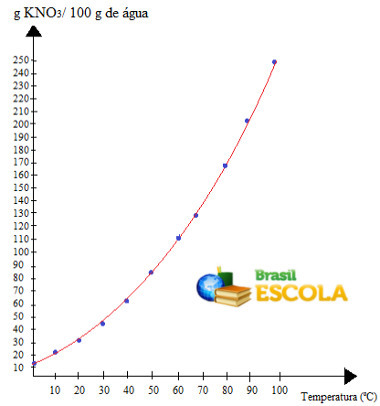
c'est l'appel courbe de solubilité de KNO3. Nous disons qu'il est ascendant parce qu'il grandit avec l'augmentation de la température.
Caractéristiques des courbes de solubilité des solutés dans un graphique
Chaque substance a son courbe de solubilité pour un solvant donné. Certaines de ces substances ont une solubilité réduite avec l'augmentation de la température, comme c'est le cas du CaCrO4, qui ont courbe de solubilité vers le bas. Cela signifie que si nous chauffons une solution saturée de ce sel, une partie du sel dissous précipitera.
Comme pour les autres substances, l'augmentation de la température n'interfère pas tellement sur la solubilité, comme cela se produit avec une solution de sel de table (NaCl). A 20°C, le coefficient de solubilité du NaCl est de 36 g dans 100 g d'eau, mais si on augmente la température à 100°C, cette solubilité n'augmentera qu'à 39,8 g, une très faible augmentation.
Il existe également des substances dans lesquelles la solubilité n'augmente que jusqu'à un certain point de l'augmentation de la température, car après cela, la solubilité diminue. Cela se produit, par exemple, avec des substances hydratées qui, lorsqu'elles sont chauffées, atteignent un moment où elles se déshydratent. Par conséquent, à mesure que sa composition change, sa variation de solubilité avec la température change également. Cette occurrence peut être observée dans le graphique à travers des inflexions dans la courbe de solubilité.
Ci-dessous, nous présentons un graphique avec courbes de solubilité de diverses substances :
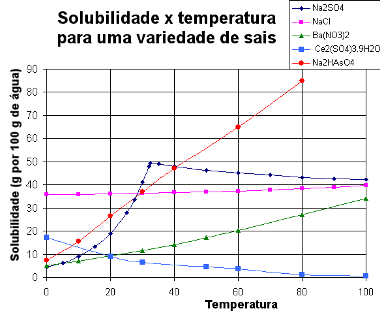
Courbes de solubilité de divers sels
Grâce à ce type de graphique, on peut comparer les solubilités de différents sels dans le même solvant et aux mêmes températures.
Classification d'une solution à l'aide d'un graphique avec une courbe de solubilité
À courbes de solubilité ils aident également à déterminer la saturation des solutions, c'est-à-dire si elles sont insaturées, saturées, saturées de fond ou sursaturées. Voir un exemple :
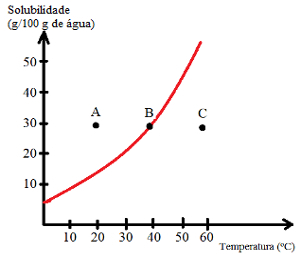
Voyez quels types de solutions sont indiqués par les points A, B et C :
A: saturé avec le bas du corps. Au point A, 30 g de soluté sont dissous dans 100 g d'eau à 20°C. La courbe montre qu'à ce stade le coefficient de solubilité est d'environ 15 g/100 g d'eau. Ainsi, comme la quantité de soluté présent est plus grande, une solution saturée avec un corps de fond est obtenue.
B: saturé. Le point B se situe exactement sur la courbe de solubilité, ce qui indique que la solution est saturée, puisqu'il y a 30 g de soluté dissous dans 100 g d'eau à 40°C. C'est donc exactement le coefficient de solubilité de ce soluté à cette température.
C: insaturé. Il y a 30 g de soluté dissous dans 100 g d'eau à 60°C. La courbe montre qu'à ce stade le coefficient de solubilité est supérieur à 50 g/100 g d'eau. Ainsi, comme la quantité de soluté dissous est inférieure au coefficient de solubilité, il existe une solution insaturée.
Ainsi, nous pouvons conclure que :
Points au-dessus de la courbe: solutions saturées avec corps de fond ;
Points sur la courbe: solutions saturées ;
Points sous la courbe: solutions non saturées.
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/graficos-das-curvas-solubilidade.htm


