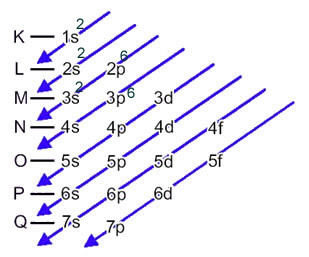
La distribution électronique des électrons d'un atome à l'état neutre ou fondamental est couramment effectuée avec le Diagramme de Pauling, indiqué ci-dessous:
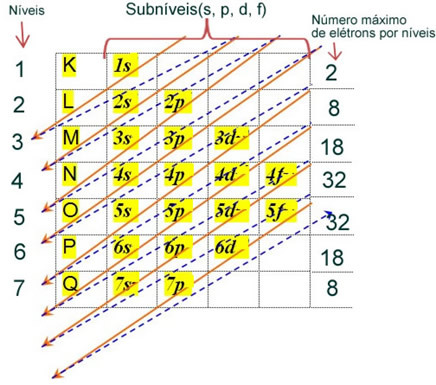
Les règles détaillées de cette diffusion se trouvent dans les deux textes suivants sur notre site Internet: «Distribution électronique des électrons" et "Règles de distribution électronique”.
La distribution électronique des ions fonctionne d'abord de la même manière que pour les atomes à l'état neutre; avec une seule différence. Puisqu'un ion est un atome qui a gagné ou perdu des électrons, nous devons en tenir compte et procéder comme suit :

Une observation importante est: le changement se fait sur le sous-niveau le plus extérieur et non sur le plus énergétique.
si l'ion est un cation, nous devons enlever les électrons qu'il a perdu. Regardons un exemple :
L'atome de fer (numéro atomique = 26) a la distribution électronique suivante dans les sous-niveaux dans l'ordre énergétique: 1s2 2s2 2p6 3s2 3p6 4s2 3d6. Quant aux couches électroniques, on a: K =2; L = 8; M = 14; N = 2.
Cette distribution est illustrée dans le diagramme de Pauling ci-dessous :
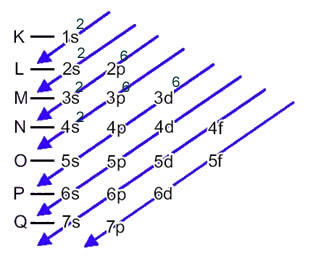
Lorsque l'atome de fer perd 2 électrons, il se transforme en cation Fe.2+. Ainsi, lors de votre distribution électronique, nous devons retirer 2 électrons de la dernière couche(N) et non le sous-niveau le plus énergétique, comme indiqué ci-dessous:
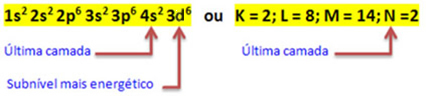
Ainsi, la distribution électronique du cation Fe2+ est donné par:
1s2 2s2 2p6 3s2 3p6 3d6 ou alors K = 2; L = 8; M = 14
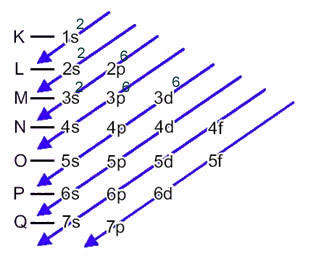
Maintenant, si nous devons effectuer la distribution électronique d'un anion, nous devons ajouter les électrons qu'il a reçus.Voyez comment cela se fait dans l'exemple suivant :
L'anion soufre (16s2-) est formé à partir de l'atome de soufre (16S) par le gain de 2 électrons, comme indiqué par la charge 2-. Sa distribution électronique de l'état fondamental est donnée par :
1s2 2s2 2p6 3s2 3p4 ou alors K = 2; L = 8; M = 6
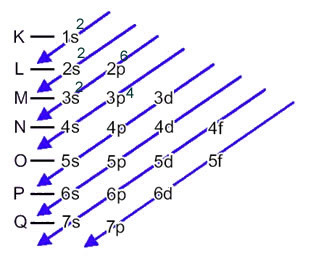
Dans ce cas, le dernier sous-niveau est le même que le sous-niveau d'énergie, 3p. On y ajoute donc les deux électrons de l'anion soufre :
1s2 2s2 2p6 3s2 3p6 ou alors K = 2; L = 8; M = 8
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/distribuicao-eletronica-ions.htm


