Pour effectuer les tâches quotidiennes et maintenir les fonctions vitales de votre corps, vous avez besoin d'énergie. Cette énergie est dérivée et remplacée par la consommation alimentaire. Lorsqu'elles sont brûlées dans notre corps, les aliments libèrent une quantité d'énergie qui dépend de la composition de chacun.
Cette quantité d'énergie fournie est appelée "calorie", dont le symbole est le cal. Nous pouvons définir plus précisément ce que la calorie représente en termes d'énergie, comme suit :

Par exemple, si 1,0 g de sucre élève la température de 1000 g d'eau de 4°C, cela signifie que 1 g d'eau absorbe 4 chaux d'énergie. Mais comme la masse considérée est de 1000 g, l'énergie totale absorbée est de 4000 cal soit 4 kcal.
Étant donné que les valeurs caloriques des aliments sont souvent très élevées, l'unité cal est à peine utilisée. Plus de kcal sont utilisés (1 kcal = 103 cal ou 1 kcal = 1000 cal).
Sur de nombreux emballages alimentaires, le symbole Cal apparaît (notez la lettre majuscule), pour représenter les valeurs énergétiques de l'aliment en « calories nutritionnelles », ce qui signifie en fait kcal.

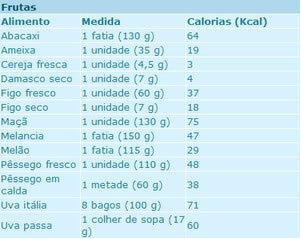
Cette unité (Cal) n'est utilisée que par certaines personnes dans le domaine de la santé, mais elle doit être évitée, car elle ne fait pas partie du SI. Cette situation génère beaucoup de confusion non seulement en matière d'alimentation, mais aussi lorsqu'elle indique la quantité d'énergie qui sera brûlée par le corps grâce à l'exercice physique. A noter que dans le tableau ci-dessous, qui indique le contenu calorique de certains aliments, les termes Calorie et kilocalorie (kcal) sont utilisés (non recommandé, comme déjà expliqué) comme synonymes :
Bien que ces unités soient largement utilisées, l'unité recommandée par le SI (Système International d'Unités) est le joule (1 cal = 4,18 J) ou le kilojoule (1 kcal = 4,18 kJ).

En fait, ce n'est pas seulement la nourriture qui libère de l'énergie lorsqu'elle est brûlée. Un charbon, par exemple, libère également de l'énergie lorsqu'il est brûlé sous forme de chaleur et de lumière. Un autre exemple est la combustion d'essence, où 1 L libère 7 750 000 calories. Ainsi, le terme « calories » s'applique à tout phénomène impliquant un échange de chaleur.
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/conteudo-calorifico-ou-calorias.htm

