À liaisons chimiques sont les interactions qui se produisent entre les atomes pour devenir une molécule ou une substance de base d'un composé. Il existe trois types de liens: covalents, métalliques et ionique. Les atomes cherchent, en créant une liaison chimique, à se stabiliser électroniquement. Ce processus s'explique par théorie de l'octet, qui dicte que chaque atome, pour atteindre la stabilité, doit avoir huit électrons dans sa couche de valence.
Les liaisons chimiques et la règle de l'octet
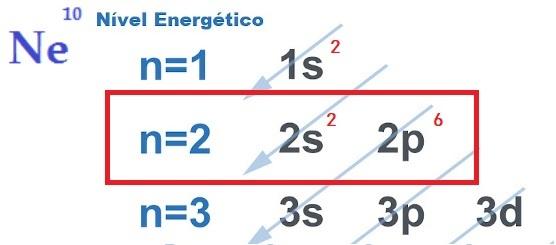
LES recherche de stabilité électronique, qui justifie la réalisation de liaisons chimiques entre atomes, s'explique par la théorie de l'octet. Proposée par Newton Lewis, cette théorie stipule que l'interaction atomique se produit de sorte que chaque élément acquiert la stabilité d'un gaz noble, c'est-à-dire huit électrons dans couche de valence.
Pour cela, l'élément donner, recevoir ou partager électrons de sa couche la plus externe, créant ainsi des liaisons chimiques de caractère ionique, covalent ou métallique. Toi
gaz nobles ce sont les seuls atomes qui ont déjà huit électrons dans leur enveloppe la plus externe et c'est pourquoi ils ne réagissent pas beaucoup avec les autres éléments.Voirégalement: Règles de diffusion électronique: comment faire ?
Types de liaisons chimiques
Pour obtenir les huit électrons dans la couche de valence comme prédit par la règle de l'octet, les atomes se lient ensemble, qui varient en fonction du besoin de donner, de recevoir ou de partager des électrons et aussi de la nature des atomes de liaison.
des liaisons ioniques
Aussi connu sous le nom liaisons électrovalentes ou hétéropolaires, se produire entre métaux et des éléments très électronégatifs (amétals et hydrogène). Dans ce type d'appel, les métaux ont tendance à perdre des électrons, se transformer en cations (ions positifs), et les non-métaux et l'hydrogène gagnent des électrons, devenir des anions (ions négatifs).
Toi composés ioniques sont durs et cassants, ont un point d'ébullition élevé et conduisent courant électrique lorsqu'ils sont à l'état liquide ou dilués dans l'eau.
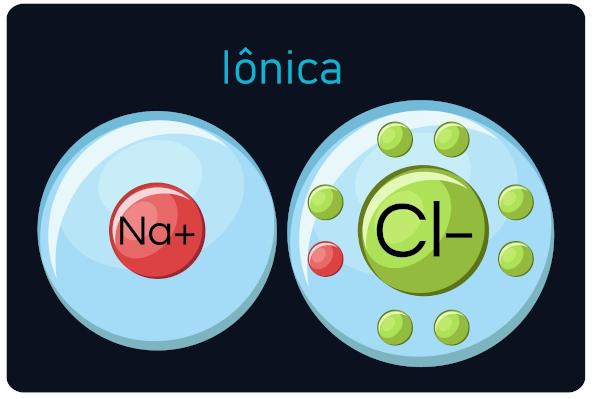
Observation: Sachez que l'atome qui gagne des électrons deviendra un ion de signe négatif et que l'atome qui perd des électrons devient un signe positif.
Exemples de substances ioniques :
- Bicarbonate (HCO3-);
- Ammonium (NH4+);
- Sulfate (SO4-).
Pour en savoir plus sur ce type de liaison chimique, visitez notre texte: des liaisons ioniques.
des liaisons covalentes
À des liaisons covalentes arriver par partage d'électrons. En raison de la faible différence d'électronégativité entre les éléments de liaison, ils ne donnent ni ne reçoivent d'électrons, mais partager des paires électroniques afin qu'ils soient stables selon la règle de l'octet. Ce type de connexion est très courant dans des éléments simples tels que Cl2, H2, ô2, et aussi dans les chaînes carbonées. la différence de électronégativité entre les ligands détermine si la liaison est polaire ou non polaire.

A lire aussi :Polarité des molécules: comment identifier ?
liaison covalente dative
Aussi appelé liaison covalente coordonnée, liaison semi-polaire, dative ou de coordination, elle est très similaire à la liaison covalente, la différence entre les deux est que l'un des atomes de la liaison dative est responsable du partage de deux électrons. Dans ce type de connexion, que se produit artificiellement, la molécule acquiert les mêmes caractéristiques qu'une molécule résultant d'une liaison covalente spontanée.
Liens métalliques
Ce type de liaison se produit entre les métaux, qui comprennent les éléments de la famille 1A (métaux alcalins), 2A (métaux alcalino-terreux) et les métaux de transition (bloc B du tableau périodique - groupe 3 à 12), formant ce que nous appelons les alliages de métaux. La caractéristique différentielle par rapport aux autres types de connexion est la mouvement des électrons, ce qui explique le fait que les matériaux métalliques, à l'état solide, sont d'excellents conducteurs électriques et thermiques. De plus, les alliages métalliques ont un point de fusion et d'ébullition élevé, une ductilité, une malléabilité et une brillance. Des exemples d'alliages métalliques sont :
acier: fer (Fe) et carbone C ;
bronze: cuivre (Cu) + étain (Sn) ;
laiton: cuivre (Cu) + zinc (Zn) ;
or: or (Au) + cuivre (Cu) ou argent (Ag).

Résumé
- Liaisons chimiques: interaction entre les atomes qui recherchent la stabilité électronique.
- Types d'appels : ionique, covalente et métallique.
- Règle de l'octet: définit que, pour que l'atome soit stable, il doit avoir huit électrons dans sa couche de valence.
exercices résolus
question 1 - (Mackenzie-SP) Pour que les atomes de soufre et de potassium acquièrent une configuration électronique égale à celle d'un gaz rare, il faut que :
(Données: numéro atomique S = 16; K = 19).
a) le soufre reçoit 2 électrons et le potassium reçoit 7 électrons.
b) le soufre donne 6 électrons et le potassium reçoit 7 électrons.
c) le soufre donne 2 électrons et le potassium 1 électron.
d) le soufre reçoit 6 électrons et le potassium cède 1 électron.
e) le soufre reçoit 2 électrons et le potassium cède 1 électron.
Résolution
Alternative E. Le soufre étant de la famille 6A ou 16, obéissant à la règle de l'octet, il doit acquérir 2 électrons pour en avoir 8 dans sa couche de valence. Le potassium, quant à lui, qui appartient à la première famille du tableau périodique (1A ou famille de l'hydrogène), pour avoir dans sa couche de valence la configuration d'un gaz noble, il lui faut perdre 1 électron. En combinant 2 atomes de potassium avec 1 atome de soufre, nous pouvons établir une liaison ionique dans laquelle les deux éléments sont électriquement stables.
question 2 - (UFF) Le lait maternel est un aliment riche en substances organiques, telles que les protéines, les graisses et les sucres, et en substances minérales telles que le phosphate de calcium. Ces composés organiques ont pour caractéristique principale les liaisons covalentes dans la formation de leurs molécules, tandis que le minéral possède également une liaison ionique. Cochez l'alternative qui présente correctement les concepts de liaisons covalentes et ioniques, respectivement :
a) La liaison covalente ne se produit que dans les composés organiques.
b) La liaison covalente se fait par transfert d'électrons, et la liaison ionique se fait en partageant des électrons avec des spins opposés.
c) La liaison covalente se fait par attraction de charges entre atomes, et la liaison ionique, par séparation de charges.
d) La liaison covalente est faite en joignant des atomes dans des molécules, et la liaison ionique, en joignant des atomes dans des complexes chimiques.
e) La liaison covalente se fait par partage d'électrons, et la liaison ionique se fait par transfert d'électrons.
Résolution
Alternative E.
Regardons les autres :
- Alternative à: incorrect car des liaisons covalentes se produisent également dans les composés inorganiques tels que le CO2.
- Alternative b: incorrecte, car les liaisons covalentes se produisent par partage et les liaisons ioniques par transfert d'électrons.
- Alternative c: La liaison covalente et la liaison ionique se produisent toutes deux par la nécessité de perdre ou de gagner des électrons, et non par l'attraction électrostatique entre les noyaux.
- Alternative d: Les deux liaisons, à la fois covalentes et ioniques, se produisent par l'union d'atomes dans une molécule.
question 3 - (PUC-MG) Examinez le tableau qui montre les propriétés de trois substances, X, Y et Z, dans des conditions ambiantes.
| Substance | Température de fusion (c°) | conductivité électrique | solubilité dans l'eau |
| X | 146 | rien |
soluble |
| oui | 1600 | haute | insoluble |
| z | 800 | juste fondu ou dissous dans l'eau | soluble |
Compte tenu de ces informations, il est CORRECT de déclarer que les substances X, Y et Z sont respectivement :
a) ionique, métallique, moléculaire.
b) moléculaire, ionique, métallique.
c) moléculaire, métallique, ionique.
d) ionique, moléculaire, métallique.
Résolution
Variante C.
La substance X est moléculaire, car les liaisons moléculaires, également appelées covalentes, ont un point d'ébullition bas, car la différence d'électronégativité entre les ligands n'est pas très grand. Généralement, les composés covalents n'ont pas de conductivité électrique et la solubilité est variable.
Nous pouvons reconnaître la substance Y comme étant métallique, car les métaux ont un point de fusion élevé, sont d'excellents conducteurs électriques et sont insolubles dans l'eau.
Enfin, la substance Z est ionique, car le point de fusion est relativement élevé pour cette substance, ce qui est une conséquence de l'arrangement cristallin de la molécule. Lorsqu'une substance ionique est dissoute dans l'eau ou à l'état liquide, elle contient des ions libres, ce qui la rend conductrice d'électrons et soluble dans l'eau.
Par Laysa Bernardes Marques
Professeur de chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/ligacoes-quimicas.htm

