LES constante d'hydrolyse (Kh) fait référence à un équilibre chimique établi à partir de l'hydrolyse d'un sel (réaction chimique impliquant un sel soluble et de l'eau).
En tant que constante de tout autre équilibre, l'expression de constante d'hydrolyse est construit à partir du produit des concentrations de produits divisé par le produit des concentrations de réactifs, comme suit :
Kh = [des produits]
[réactifs]
Travailler avec la constante d'hydrolyse implique la connaissance de trois phénomènes importants :
- Dissociation des sels;
- Ionisation de l'eau;
- Hydrolyse du sel.
Dissociation des sels
Lorsqu'un sel soluble est ajouté à l'eau, il se dissocie et libère un cation autre que l'hydronium (H+) et un anion autre que l'hydroxyle (OH-).

Pour vous rappeler quand un sel est soluble ou non dans l'eau, Cliquez ici et étudier la table de solubilité du sel.
ionisation de l'eau
L'eau est une substance qui subit naturellement le phénomène d'auto-ionisation, c'est-à-dire qu'elle produit un cation hydronium et un anion hydroxyle.
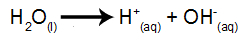
équation d'ionisation de l'eau
hydrolyse d'un sel
En tant que sel soluble, il libère des ions dans l'eau et l'eau subit une ionisation, produisant ions au milieu, la réaction (hydrolyse) entre les ions sels et les ions eau peut avoir lieu. Lorsque cette réaction se produit, les interactions possibles sont :
- Cation du sel avec l'anion de l'eau (formation d'une base) ;
- Anion de sel avec le cation d'eau (formation d'un sel);
Les interactions ci-dessus ne se produiront que si la base ou l'acide formé est faible.
Voir un exemple d'hydrolyse d'un sel :
→ Hydrolyse de l'hypochlorite d'ammonium (NH4ClO)
Lorsque l'hypochlorite d'ammonium est ajouté à l'eau, il se dissout et se dissocie, libérant les ions cations ammonium (NH4+) et l'anion hypochlorite (ClO-):

Équation montrant les ions libérés lors de la dissociation de l'hypochlorite d'ammonium
Comme l'eau, lorsqu'elle subit une ionisation, produit H+ et OH-, nous avons dans la solution deux cations et deux anions, qui peuvent réagir. Le cation NH4+ ne réagit qu'avec l'anion OH- car il forme une base faible (NH4OH). L'anion ClO- ne réagit qu'avec le cation H+ car il forme un acide faible (HClO).

Équation d'équilibre de l'hydrolyse de l'hypochlorite d'ammonium
Construction de l'expression de la constante d'hydrolyse
La construction de la constante d'hydrolyse d'un sel dépend exclusivement de l'équation d'hydrolyse de ce sel. L'hydrolyse de l'hypochlorite d'ammonium, par exemple, travaillée dans le point précédent, a généré l'équation suivante :

Équation d'équilibre de l'hydrolyse de l'hypochlorite d'ammonium
Comment construire l'expression de constante d'hydrolyse prend en compte les produits et les réactifs, l'expression de la constante serait :
Kh = [HClO].[NH4OH]
[ClO-].[NH4+]
REMARQUE: L'eau ne participe pas à l'équation car c'est un réactif liquide et aussi parce que c'est le moyen fondamental pour l'apparition de l'hydrolyse, c'est-à-dire qu'elle est constante.
Par moi Diogo Lopes Dias
La source: École du Brésil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-constante-hidrolise.htm
