Une réaction d'oxydation énergétique dans les alcènes se produit lorsqu'il y a une rupture de la molécule, c'est-à-dire la rupture simultanée des deux doubles liaisons et la entrée d'oxygène dans la molécule organique.
Il est possible d'effectuer ce type de réaction avec des alcènes en utilisant du permanganate de potassium (KMnO4) ou le bichromate de potassium (K2Cr2O7) concentré, en milieu acide, à chaud.
Dans le milieu acide, il y a des ions H3O+ provoquant la décomposition de KMnO4 et libérant 5 atomes d'oxygène naissant [O] pour chaque 2 KMnO4. Notez cette décomposition ci-dessous :

Cette réaction est dite "énergétique" car elle rompt les deux liaisons du double (en oxydation légère seule la liaison est rompue pi), un autre facteur est que cette réduction du manganèse en milieu acide est beaucoup plus intense qu'en milieu basique, comme elle se fait en milieu oxydation légère.
L'oxygène naissant libéré réagit alors avec un alcène, mais le produit final dépend de ce que le types de carbone qui font la double liaison, c'est-à-dire qu'ils soient primaires, secondaires ou tertiaire. Voyez ce qui se passe dans chaque cas :
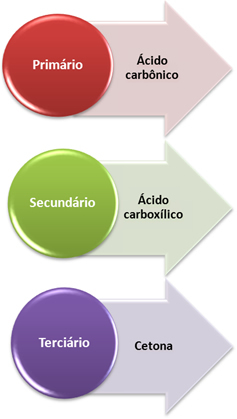
- Carbone primaire : Si l'insaturation est comprise entre deux carbones primaires, les produits formés seront deux acides carboniques (H2CO3). Si un seul des carbones de la double liaison est primaire, une seule des molécules formées sera de l'acide carbonique. Cependant, ce composé est instable et n'a jamais été isolé, il se décompose en eau et dioxyde de carbone.
- Carbone secondaire : Si l'insaturation est comprise entre deux carbones secondaires, les deux produits formés seront acides carboxyliques. Si un seul des carbones est secondaire, il donnera naissance à une molécule d'acide carboxylique, tandis que l'autre dépendra de l'autre carbone.
- Carbone tertiaire : Donne lieu à cétone.
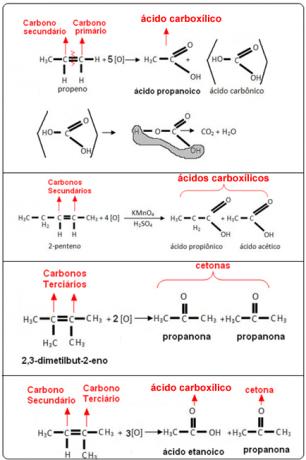
Voir les exemples suivants :
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/oxidacao-energetica-alcenos.htm