arrive à transformationisochore lorsqu'une masse donnée d'un gaz subit des changements de Température qui déclenchent des changements de pression ou vice versa, étant donné que la température et pression, dans ce cas, sont des quantités directement proportionnelles, tandis que le volume du système reste inchangé.
Voir aussi: Qu'est-ce que la pression partielle des gaz?
Qu'est-ce qu'une transformation isochore ?
Une transformation isochore se produit lorsqu'un changement de température et de pression se produit sur une masse donnée de gaz, mais que son volume reste le même. Le changement de pression sera directement proportionnel à la température, c'est-à-dire que si un gaz, dans un certain système fermé, double sa température absolue, cela entraînera une augmentation de la pression au double de ce qu'elle était initialement.
Ce type de transformation est aussi appelé isovolumétrique ou isométrique. Le terme isochore vient du grec Isokhora, sur quoi iso signifie « égal » et khora signifie « lieu ou volume » (dans ce contexte).
Exemples:
Les pneus d'une voiture subissent une transformation isochore, on peut l'observer lorsqu'on fait sa étalonnage. Par temps chaud, la pression indiquée sur le moniteur d'étalonnage est plus élevée que par temps froid. En effet, avec une augmentation de la température, la pression augmente, puisque le volume reste.

D'autres exemples sont les déodorants en spray, dans ce type de produit il y a un avertissement sur l'étiquette de ne pas être stocké ou soumis à des températures élevées, car, en plus du fait que certaines de ses substances sont inflammables, il y a la condition de transformation isochore ou isovolumétrique. Comme les déodorants en aérosol sont à l'intérieur d'une bouteille scellée et à l'état gazeux, le une augmentation de la température entraînera une augmentation de la pression et le risque d'explosion.
Caractéristiques d'une transformation isochore
- Volume constant.
- La pression et la température sont directement proportionnelles.
Ces caractéristiques peuvent être décrites par les formules suivantes :

Graphique d'une fonction isochore
Notez le tableau suivant qui décrit le comportement d'un gaz en fonction de la pression, de la température et de la constante résultante.
Température (°C) |
Pression (atm) |
P/T = constante |
50 |
5 |
10 |
100 |
10 |
10 |
150 |
15 |
10 |
200 |
20 |
10 |
Notez que la pression suit l'augmentation de la température de sorte que le rapport P/T reste constant, ce qui signifie que la pression et la température sont des quantités directement proportionnelles. Par conséquent, le graphe décrivant les transformations isochores est de type linéaire. Voir:

Qui a découvert la transformation isochore ?
Jacques Alexandre César Charles (1746-1823) était le scientifique français qui, étudiant le comportement des gaz dans un système fermé pour la création d'un thermomètre de précision, a conclu les études sur les transformations isochores.
Le scientifique Joseph Louis Gay Lussac (1778-1850) a également développé une étude sur l'expansion et le retrait d'un système gazeux. Il s'agissait d'analyses indépendantes, mais parce qu'elles sont arrivées à la même conclusion, elles ont divisé les crédits. Aujourd'hui, certains auteurs se réfèrent aux deux dernières lois physiques des gaz qui expliquent la transformations isobares et isochore comme 1ère et 2ème lois de Charles-Gay-Lussac.
Voir aussi: Loi volumétrique de Gay-Lussac
Des exercicesrésolu
Question 1 - (PUC-RJ) Un pneu de vélo est calibré à une pression de 4 atm, par temps froid, à une température de 7 °C. Le volume et la quantité de gaz injecté sont les mêmes. Quelle sera la pression d'étalonnage dans le pneu lorsque la température atteint 37°C ?
a) 21,1 guichets automatiques
b) 4,4 atm
c) 0,9 atm
d) 760 mmHg
e) 2,2 guichets automatiques
Résolution
Variante A
1ère étape: identifier le système et extraire les données.
Système isovolumétrique
P1 = 4 atm
T1 = 7°C
T2 = 37°C
P2 = ?
En utilisant la formule:
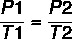
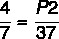
7 x P2 = 37 x 4
P2 = 148 / 7
P2 = 21,14 atm
Question 2 - (Unifor-CE) Examinez la figure ci-dessous.
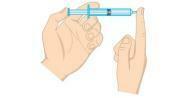
La pression du gaz à l'intérieur de la seringue peut être diminuée :
a) placer la seringue dans de l'eau glacée, en gardant l'extrémité coiffée.
b) en serrant le piston, en gardant l'extrémité fermée.
c) placer la seringue dans de l'eau chaude, en gardant l'extrémité coiffée.
d) ouvrir l'embout et expulser la moitié de l'air hors de la seringue.
e) en tirant sur le piston, en gardant l'extrémité ouverte.
Résolution
Alternative A. La pression d'un gaz est directement proportionnelle à la température dans un système isochore, c'est-à-dire sans changer le volume ou la masse du gaz. Quand il y a une baisse de température, il y aura aussi une baisse de pression.
Par Laysa Bernardes Marques de Araujo
Professeur de chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/transformacao-isocorica.htm

