Pour qu'une réaction chimique se produise, il est nécessaire de satisfaire quatre conditions de base, qui sont :
1. Les réactifs doivent contacter ;
2. Il doit y avoir une affinité chimique entre les réactifs ;
3. Les collisions entre particules de réactif doivent être efficaces ;
4. L'énergie d'activation doit être atteinte.
Voir brièvement chaque cas :
1.Contact entre réactifs :
Cette condition est évidente, car même si les réactifs ont beaucoup d'affinité les uns pour les autres, comme dans le cas des acides et des bases, s'ils sont séparés, la réaction ne se produira pas. Ils doivent entrer en contact pour que leurs particules puissent entrer en collision, rompant les liaisons des réactifs et formant les liaisons des produits.

2.Affinité chimique :
Comme nous l'avons vu, la mise en contact des réactifs est nécessaire, mais pas suffisante. Par exemple, si on met du sodium en contact avec de l'eau, une réaction extrêmement violente va se produire, mais si on met de l'or, on ne verra aucune différence. En effet, différentes substances ont des affinités chimiques différentes les unes avec les autres, ou elles peuvent n'avoir aucune affinité du tout. Plus l'affinité chimique est grande, plus la réaction est rapide.
Dans les exemples cités, le sodium a une grande affinité avec l'eau, à tel point que pour ne pas entrer en contact avec l'humidité de l'air, le sodium métallique est stocké dans le kérosène. L'or est inerte, c'est pourquoi les monuments en or durent si longtemps, comme les sarcophages d'Egypte.

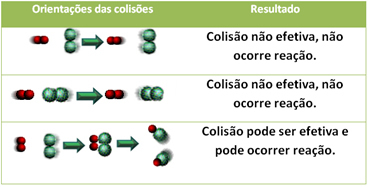
3.Théorie des collisions :
Même dans les composés qui ont une affinité chimique, pour que la réaction ait lieu, il est nécessaire que leurs particules, atomes ou molécules entrent en collision efficacement. Toutes les particules qui entrent en collision ne le font pas efficacement, mais les chocs qui entraînent la rupture du les liaisons réactives et la formation de nouvelles liaisons sont celles qui se produisent dans la bonne orientation et avec l'énergie suffisant.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Le cas ci-dessous montre le cas de deux collisions inefficaces et d'une collision efficace qui entraîne la réaction.
4.Énergie d'activation et complexe activé :
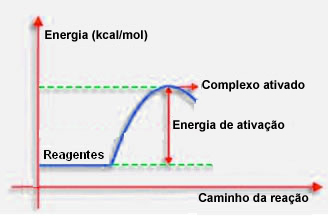
Comme indiqué dans le point précédent, une collision efficace, en plus d'un guidage favorable, nécessite également une énergie suffisante. La quantité minimale d'énergie nécessaire pour que chaque réaction ait lieu s'appelle l'énergie d'activation.
Si les réactifs ont une énergie égale ou supérieure à l'énergie d'activation, lors du choc bien orienté, il se formera un complexe initialement activé, qui est une structure intermédiaire entre les réactifs et le des produits. Dans le complexe activé, il y a des liaisons réactives affaiblies et de nouvelles liaisons produit se forment.
Ainsi, l'énergie d'activation fonctionne comme une sorte de barrière pour que la réaction se produise, car plus elle est grande, plus il sera difficile pour la réaction de se produire. Dans certains cas, il est nécessaire de fournir de l'énergie aux réactifs. Par exemple, le gaz de cuisine a une affinité pour interagir avec l'oxygène de l'air, mais nous devons fournir de l'énergie lorsque nous rassemblons l'allumette, sinon la réaction n'a pas lieu. Mais une fois démarrée, la réaction elle-même libère suffisamment d'énergie pour activer les autres molécules et maintenir la réaction.
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Conditions d'occurrence de réactions chimiques »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/condicoes-para-ocorrencia-reacoes-quimicas.htm. Consulté le 27 juin 2021.


