La quantité de calories dépend de la constitution de l'aliment. Ainsi, pour déterminer expérimentalement la quantité de chaleur dégagée par les aliments et qui peut être absorbée par l'organisme, on utilise un appareil appelé calorimètre.
Cet appareil mesure la chaleur dégagée par les aliments lorsqu'ils sont brûlés. Il existe plusieurs types de calorimètres; le premier d'entre eux a été créé en 1780 par Lavoisier et Laplace et était un calorimètre à glace.
De nos jours, le plus utilisé et qui tient compte du concept de calories expliqué ci-dessus est le calorimètre à eau. Ce dispositif est recouvert d'un matériau isolant pour éviter les déperditions thermiques du milieu; et l'aliment à analyser est placé dans le chambre de combustion, qui contient de l'oxygène gazeux et électrodes. Ces électrodes subissent une décharge électrique et provoquent leur inflammation et combustion des aliments.
La masse connue d'eau contenue dans le calorimètre absorbe la chaleur dégagée par les aliments brûlés et un
thermomètre mesure l'augmentation de la température de l'eau. De plus, le calorimètre contient un agitateur ce qui permet à la température de l'eau de rester uniforme dans son intégralité.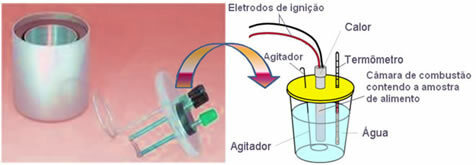
Donc, si on utilise, par exemple, une masse de 1 gramme de sucre et que le calorimètre a 1000 g d'eau, et on observe qu'au final de la réaction, la température de l'eau est passée de 20°C à 24°C, c'est-à-dire qu'elle a augmenté de 4°C, on peut alors atteindre la valeur énergétique de la du sucre. Comme? Eh bien, compte tenu du concept initial de calories, nous avons :
| Montée de 1°C → 1 cal par gramme d'eau |
| Montée de 4°C → 4 cal par gramme d'eau |
Donc 1 g d'eau absorbe 4 chaux. Cependant, 1000 g d'eau ont été utilisés et, considérant que toute la chaleur dégagée lors de la combustion a été absorbée par celle-ci, l'énergie totale absorbée par l'eau était de 4000 cal ou 4 kcal. Par conséquent, nous concluons que :
| La valeur énergétique du sucre = 4000 cal/g ou 4 kcal/g. |
Passage au SI :
1 kcal 4,18 kJ
4 kcal/g x
x = 16,72 kJ/g
De plus, nous pouvons utiliser l'équation suivante pour calculer la quantité de chaleur cédée ou absorbée par l'eau :
| Q = m. ç. t |
Où:
Q = chaleur cédée ou absorbée par l'eau ;
m = masse d'eau ;
c = chaleur spécifique de l'eau, qui est égale à 1,0 cal/g. °C ou 4,18 J/g. °C ;
Δt = variation de la température subie par l'eau, qui est donnée par la diminution de la température finale par la température initiale (tF – tje).
En utilisant cette formule on obtient le même résultat :
Q = m. ç. t
Q = 1000 g. 1,0 cal/g. °C. (24-20)°C
Q=4000 cal
Q = 4,0 kcal
ou alors
Q = m. ç. t
Q = 1000 g. 4,18 kJ/g. °C. (24-20)°C
Q= 16,72 kJ
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/medindo-as-calorias-dos-alimentos-por-meio-um-calorimetro.htm