Toi métaux ce sont des éléments chimiques qui ont pour principale caractéristique physique la capacité de perdre des électrons et, par conséquent, de former des cations métalliques. Pour cette raison, ils peuvent faire deux types de liaisons chimiques: la liaison ionique et la lien métallique.
LES liaison ionique se produit lorsqu'un métal interagit avec un élément de nature métallique, ce qui peut être un amétal ou hydrogène. Dans ce type de liaison, nous avons la perte d'électrons par les métaux et le gain d'électrons par les non-métaux ou l'hydrogène.
déjà le lien métallique s'établit entre les atomes d'un même élément métallique. Ce type de liaison ne se produit qu'entre les atomes d'un même métal et exclusivement parce qu'un métal ne peut pas établir de liaison chimique avec un autre élément métallique différent.
Caractéristiques générales des métaux
Solides à température ambiante, à l'exception du mercure ;
Ils sont brillants ;
Ils ont des points de fusion et d'ébullition élevés;
Ils sont généralement de couleur argent, à l'exception de l'or, qui est doré, et du cuivre, qui est rougeâtre ;
Les métaux purs sont formés d'amas d'atomes (d'un seul élément chimique) appelés réseaux cristallins.
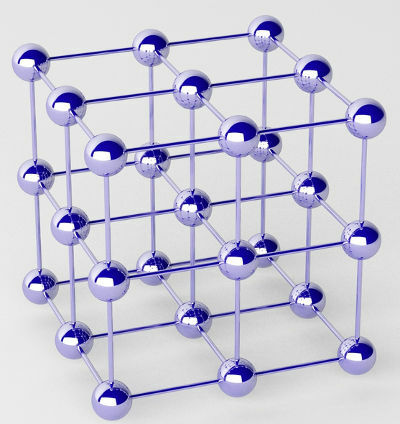
Représentation du réseau cristallin d'un métal
Principes du collage métallique
À lien métallique, les réseaux cristallins qui forment les métaux sont en fait un amas ionique (composé uniquement de cations et électrons). Les électrons présents dans la couche de valence des atomes métalliques sont délocalisés, c'est-à-dire qu'ils quittent la couche de valence, faisant de l'atome un cation (déficient en électrons).
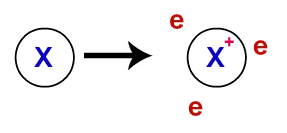
Représentation des électrons délocalisés de la couche de valence
Après avoir été délocalisés, les électrons des atomes métalliques commencent à entourer les cations, formant une véritable « mer d'électrons ». Chacun des électrons présents dans cette mer a la capacité de se déplacer librement à travers le réseau cristallin du métal.

Représentation du modèle de mer d'électrons
REMARQUE: Les électrons "de la mer" ne sont pas capables de quitter le réseau cristallin et de le traverser.
Propriétés des métaux justifiées par le collage métallique
a) Malléabilité
Grâce à un métal, il est possible de produire des tôles de différentes épaisseurs et tôles. C'est grâce à cette propriété des métaux que l'on peut construire divers objets, tels que des couteaux, des épées, etc.

La lame d'une épée est faite d'un métal
b) Conductivité
Les métaux, en général, sont de bons conducteurs de courant électrique et de chaleur. Lorsqu'un métal quelconque est en contact avec une source de chaleur ou une source de courant électrique, il est capable de les conduire.

Une casserole en aluminium dans la flamme d'un poêle devient entièrement chaude en raison de la conductivité.
c) Ductibilité
Grâce à un métal, nous pouvons produire des fils. L'utilisation d'un métal sous forme de fils facilite son utilisation, notamment en ce qui concerne la conductivité électrique.

Un métal, tel que le cuivre, peut être utilisé pour produire des fils.
Par moi Diogo Lopes Dias
La source: École du Brésil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ligacao-metalica.htm