Gazidéal est celui où le collisions entre les particules sont parfaitement élastiques. Entre ses particules, il n'y a aucune sorte d'interaction, comme les forces attractives ou répulsives, de plus, ces particules ne prennent pas de place.
Selon le théorie cinétique des gaz, l'état thermodynamique d'un gaz parfait est complètement décrit par les variables de pression, volume et Température.
Voirégalement: Calorimétrie: carte mentale, formules et exercices résolus
concept de gaz parfait
Les gaz parfaits sont composés exclusivement de particulesdansdimensionsponctuelle (de taille négligeable) qui sont en mouvementchaotique est sur hauterapidité. Dans ce type de gaz, la température et la vitesse de translation des particules sont proportionnelles.
Comme il n'y a pas d'interaction entre les particules d'un gaz parfait, le énergie interne de ce gaz est toujours égal à la somme des énergie cinétique de toutes les particules qui le constituent.
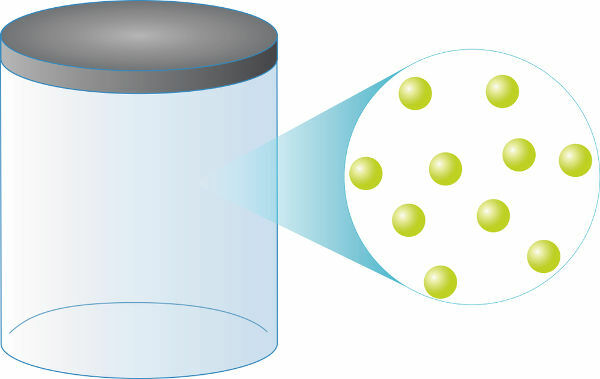
Quels que soient les gaz parfaits, ils auront toujours le même numérodansparticules pour le même volume. Leur masse, à son tour, dépendra directement de votre masse molaire (mesurée en g/mol), en plus, 1 mole de gaz parfait (environ 6.0.1023 particules) occupera toujours un volume égal à 22,4 l.
Toi des gazréel, où il y a apparition de collisionsinélastique entre les particules, se rapprochent beaucoup du comportement des gaz parfaits dans régimes à basse pression et à haute température. Par coïncidence, dans des conditions normales de pression et de température sur Terre (25 °C et 1 atm), la plupart des les gaz se comportent comme des gaz parfaits, ce qui facilite le calcul des prédictions sur le comportement thermodynamique leur.
Certains gaz, comme le vapeur d'eau, qui est dilué dans le gaz atmosphérique, ne peuvent pas être considérés comme des gaz parfaits mais oui des gazréel. Ces gaz ont des interactions importantes entre leurs particules, qui peuvent condenser, les faisant liquéfier, Si il y en a un chute de température.
Caractéristiques des gaz parfaits
Vérifiez-le à abstrait, quelques caractéristiques des gaz parfaits :
- En eux, seules des collisions parfaitement élastiques entre particules se produisent ;
- En eux, il n'y a pas d'interactions entre les particules;
- Les particules y ont des dimensions négligeables ;
- 1 mole de gaz parfait occupe un volume de 22,4 l, quel que soit le gaz ;
- Les gaz réels se comportent comme des gaz parfaits lorsqu'ils sont soumis à des régimes à basse pression et à haute température ;
- La plupart des gaz se comportent de la même manière que les gaz parfaits.
loi des gaz parfaits
L'étude des gaz développée par les chercheurs Charlesgarçon,JosephLouisgay-lussac et Robertgarçon conduit à l'émergence de trois lois empiriques, utilisé pour expliquer le comportement des gaz parfaits dans des régimes de Température, pression et le volumeconstantes, respectivement.
Ensemble, ces lois ont constitué la base nécessaire à l'émergence de loi des gaz parfaits, qui relate la état thermodynamique initial d'un gaz, défini par les quantités P1, T1 et V1, Avec votre état thermodynamique final (P2, V2 et T2), après avoir subi quelques transformation de gaz.
Vérifiez formule de la loi générale des gaz :
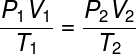
La loi générale sur les gaz stipule que le produit donne pression la fourrure le volumedegaz, divisé par la température thermodynamique, en kelvin, est égal à une constante. Cette constante, à son tour, est décrite par la équation de Clapeyron, Regardez:
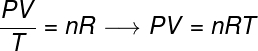
non – nombre de moles (mol)
R – constante universelle des gaz parfaits (0,082 atm.l/mol. K ou 8,31 J/mol. K)
Dans la formule, P est la pression exercée par le gaz, V est le volume occupé par ce gaz, et T est la température, mesurée en kelvin. la grandeur non fait référence au nombre de moles, tandis que R est la constante universelle des gaz parfaits, qui est souvent mesurée en unités d'atm.l/mol. K ou en J/mol. K, cette dernière étant adoptée par le SI.
Voirégalement:Qu'est-ce que le vent solaire et comment affecte-t-il l'atmosphère terrestre ?
Énergie interne du gaz parfait
LES énergieinterne des gaz parfaits peut être calculé en utilisant le produit entre le constantdansBoltzmann et la température thermodynamique, notez :
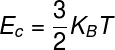
KB – Constante de Boltzmann (KB = 1,38.10-23 J/K)
A partir de la relation précédente, qui permet de calculer la énergie cinétique moyenne à partir des particules d'un gaz parfait, nous tirons la formule suivante, qui peut être utilisée pour calculer ce que le vitesse quadratique moyenne des molécules d'un gaz parfait, pour une température T donnée, notez :
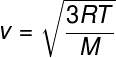
M – masse molaire (g/mol)
Cette formule permet de voir qu'un une additionàTempérature d'un gaz parfait entraîne une augmentation de la vitesse quadratique moyenne des particules.
Savoir plus:Découvrez de quoi est faite la lumière et quelles sont ses caractéristiques
Exercices résolus sur les gaz parfaits
Question 1) Deux moles d'un gaz parfait, et à une pression de 1 atm, se trouvent à une température de 227 °C. Calculez, en litres, le volume occupé par ce gaz.
Données: R = 0,082 atm.l/mol. K
a) 75 l
b) 82 l
c) 15 l
d) 27 litres
e) 25 litres
Modèle: La lettre B
Résolution:
Pour calculer le volume de ce gaz, nous utiliserons l'équation de Clapeyron, cependant, avant de faire le calcul, il est nécessaire de transformer la température de 227 °C en kelvin. Pour cela, nous ajoutons le facteur 273 à cette température, ce qui donne une température de 500 K.
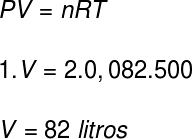
Selon la résolution, le volume occupé par le gaz est de 82 litres.
Question 2) Un gaz parfait occupe un volume de 20 l, lorsqu'il est soumis à une pression de 3 atm, de sorte que sa température reste constante, tandis que son volume est triplé. Calculez la pression finale de ce gaz après qu'il ait subi cette transformation.
a) 1 guichet automatique
b) 3 guichets automatiques
c) 5 guichets automatiques
d) 8 guichets automatiques
e) 9 guichets automatiques
Modèle: Lettre a
Résolution:
Pour résoudre cet exercice, nous utiliserons la loi générale des gaz, notez :
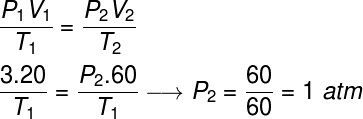
Pour faire le calcul, il a fallu attribuer un volume de 60 l au gaz, puisque son volume a triplé lors de la transformation.
Par Rafael Hellerbrock
Professeur de physique
